Efekty narażenia pszczół na działanie neonikotynoidów
W ostatnich latach zarówno w krajach Unii Europejskiej, jak i Stanach Zjednoczonych trwają burzliwe dyskusje dotyczące stosowania neonikotynoidów w rolnictwie. Głównym powodem tych debat jest powiązanie powszechnego stosowania pestycydów z tej grupy ze zjawiskiem masowego ginięcia pszczół (z ang. colony collapse disorder, CCD).

fot. Pixabay, gadelgeo
Od wczesnych lat 90. środki te są komercyjnie wykorzystywane w rolnictwie, a na temat ich oddziaływania na pszczoły ukazało się ponad 100 prac naukowych. Na przykład imidakloprid jest obecnie najczęściej wykorzystywanym insektycydem na świecie [Yamamoto i Casida 1999], a zyski z jego sprzedaży sięgają miliarda dolarów rocznie [Aliouane i in. 2009].
Czym właściwie są neonikotynoidy?
Neonikotynoidy stanowią grupę insektycydów neurotoksycznych; chemicznie podobne są do nikotyny. Należą do nich między innymi: imidakloprid, acetamiprid, klotianidyna, tiametoksan, tiakloprid, dinotefuran i nitenpyram. Stosowane są w postaci oprysków, zapraw nasiennych czy dodatków do gleb w celu zwalczania m.in. mszyc i mączników.
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Mechanizm działania neonikotynoidów
Aby zrozumieć sposób działania neonikotynoidów, niezbędna jest wiedza o budowie oraz funkcjonowaniu układu nerwowego owadów. Przewodzenie impulsów nerwowych pomiędzy komórkami nerwowymi, a także z komórek nerwowych do mięśni odbywa się poprzez synapsy.
Synapsa składa się z neuronu pre- i postsynaptycznego, a także szczeliny synaptycznej pomiędzy sąsiadującymi komórkami nerwowymi (ryc. 1).
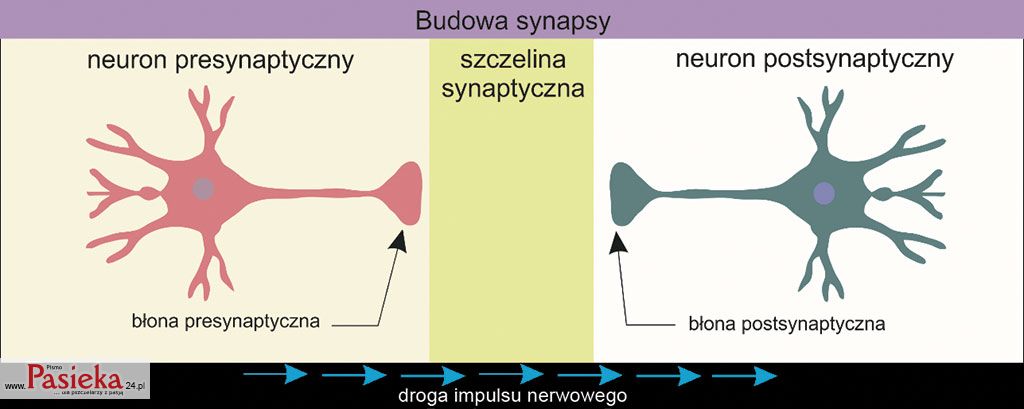
Ryc. 1. Schematyczna budowa synapsy.
Impuls nerwowy wywołany bodźcem przekazywany jest wzdłuż komórki nerwowej, aż dotrze do zakończenia neuronu. Dzięki synapsie możliwe jest przekazanie impulsu nerwowego do kolejnej komórki nerwowej. Impuls nerwowy docierający do zakończenia neuronu pobudza wydzielanie do szczeliny synaptycznej neurotransmitera z pęcherzyka synaptycznego (procesy nr 1 i 2 na ryc. 2).
Następnie neurotransmiter wiąże się ze specyficznym receptorem na błonie postsynaptycznej (proces nr 4 na ryc. 2). Kompleks neurotransmiter-receptor indukuje powstawanie impulsu nerwowego w neuronie postsynaptycznym, który następnie przekazywany jest wzdłuż neuronu.
Dalej kompleks ten ulega rozpadowi, a neurotransmiter zostaje rozłożony przez specyficzny enzym (proces nr 5 na ryc. 2). Produkty tego rozpadu transportowane są do neuronu, który go zsyntezował (neuron presynaptyczny; proces nr 6 na ryc. 2).
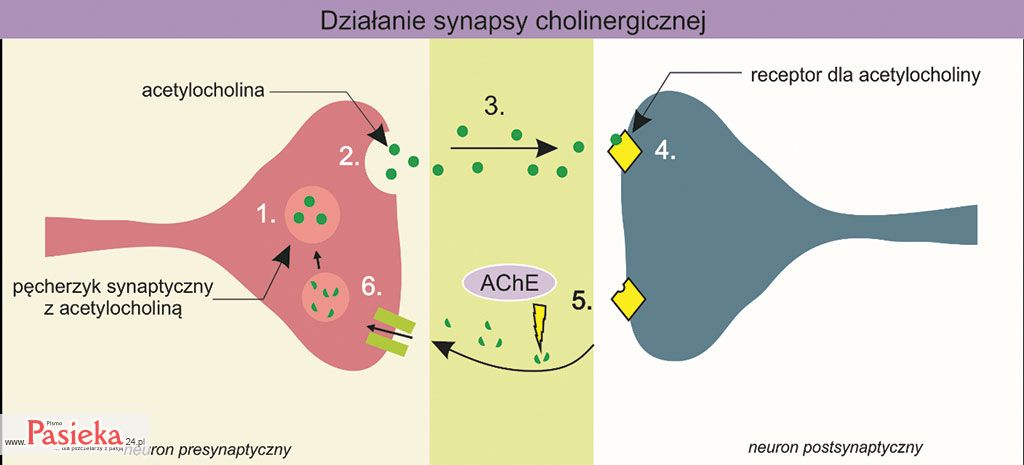
Ryc. 2. Ogólny schemat działania synapsy na przykładzie synapsy cholinergicznej. Uwolnienie neurotransmitera – acetylocholiny (2) z pęcherzyka synaptycznego (1) do szczeliny synaptycznej (3). Wiązanie acetylocholiny z receptorem na błonie postsynaptycznej (4). Reakcja rozkładu acetylocholiny przez enzym – acetylocholinosterazę (AChE) (5). Transport produktów rozpadu acetylocholiny do neuronu presynaptycznego (6). Na podstawie: bioninja.com
Proces rozpadu kompleksu neurotransmiter-receptor oraz usunięcie neurotransmitera ze szczeliny synaptycznej są bardzo istotne dla funkcjonowania układu nerwowego. Ciągła obecność neurotransmitera w szczelinie synaptycznej oraz ciągłe pobudzenie neuronu postsynaptycznego powoduje stałe generowanie impulsów nerwowych.
Do najważniejszych owadzich neurotransmiterów można zaliczyć acetylocholinę (występującą również u ludzi). U pszczoły miodnej neurotransmiter ten odgrywa istotną rolę w uczeniu się, zapamiętywaniu, odbieraniu i przetwarzaniu wrażeń wzrokowych i zapachowych [Breer i in. 1987; Lozano i in. 1996, 2001; Thany i in. 2005].
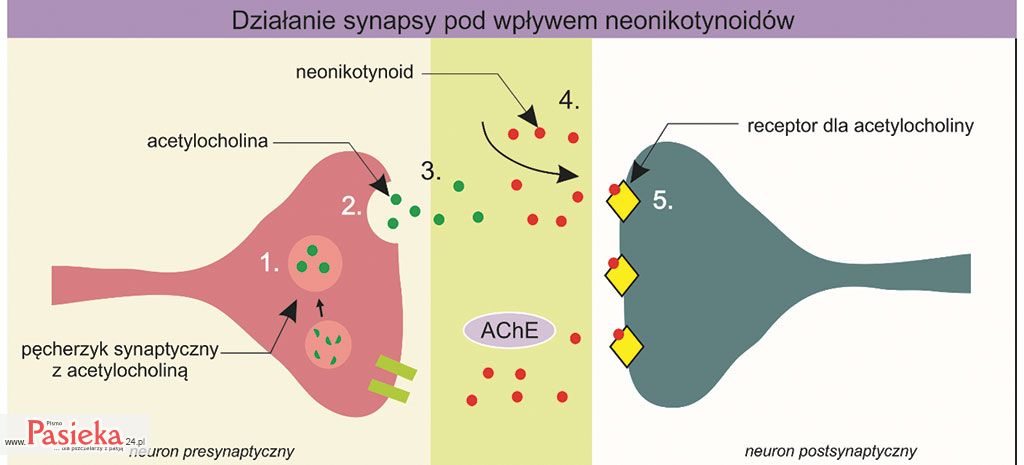
Ryc. 3. Ogólny schemat działania neonikotynoidów na synapsę cholinergiczną. Impuls nerwowy indukuje uwolnienie acetylocholiny (2) z pęcherzyka synaptycznego (1) do szczeliny synaptycznej (3). Narażenie owada na neonikotynoidy powoduje pojawienie się pestycydu w szczelinie synaptycznej (4), jego związanie z receptorem dla acetylocholiny na błonie postsynaptycznej (5). Enzym – acetylocholinoesteraza (AChE) nie może rozłożyć neonikotynoidów, co w konsekwencji prowadzi do kumulowania pestycydów w szczelinie synaptycznej. Na podstawie: bioninja.com
Neonikotynoidy są zdolne do wiązania się z receptorami acetylocholiny na błonie postsynaptycznej owadów (proces 5 na ryc. 3) i wywołania identycznego efektu jak kompleks acetylocholina-receptor – generowania impulsu nerwowego w neuronie postsynaptycznym.
Jednakże problem z neonikotynoidami pojawia się w momencie, kiedy kompleks neurotransmiter-receptor powinien być rozbity, a neurotransmiter rozłożony przez enzym. Enzym specyficzny dla acetylocholiny – acetylocholinoesteraza (AchE), nie jest w stanie rozłożyć neonikotynoidów.
W konsekwencji dochodzi do nagromadzenia się neonikotynoidów w szczelinie synaptycznej (ryc. 3), ciągłego generowania impulsów nerwowych w neuronie postsynaptycznym, drgawek, paraliżu, a w ostateczności – do śmierci owada [Gervais i in. 2010; Yamamoto i Casida 1999].
Toksyczność neonikotynoidów dla pszczół
Śmiertelność
Neonikotynoidy, poza toksycznym działaniem na szkodniki upraw, zostały również zaklasyfikowane jako wysoce toksyczne dla pszczół [European Food Safety Authority 2013].
Wykorzystywany w ekotoksykologii parametr LD50 dla tej grupy pestycydów (dawka substancji, która powoduje śmierć 50% osobników z badanej populacji) różni się dla pszczoły miodnej w zależności od użytej substancji aktywnej i sposobu podania [Decourtye i Devillers 2010; Iwasa i in. 2004; Suchail i in. 2000].
Neonikotynoidy wykazują różną toksyczność w zależności, czy przedostają się do organizmu drogą pokarmową, czy kontaktowo (tab. 1).
| Zastosowany środek | LD50 [µg/pszczołę] | Źródło | |
|---|---|---|---|
| Droga pokarmowa | Kontaktowo | ||
| Imidakoprid | 0,007 | 0,018 | Suchail i in. (2000); Iwasa i in. (2004) |
| Acetamiprid | 14,5 | 8,079 | Decourtye i Devillers (2010) |
| Klotianidyna | 0,003 | 0,044 | Decourtye i Devillers (2010) |
| Dinotefuran | 0,023 | 0,075 | Iwasa i in. (2004), Decourtye i Devillers (2010) |
| Tiakloprid | 17,3 | 38,8 | Decourtye i Devillers (2010) |
| Tiametoksam | 0,005 | 0,024 | Decourtye i Devillers (2010) |
Warty odnotowania jest również fakt, iż często wraz z pestycydami stosowane są substancje wzmacniające ich toksyczne działanie – tzw. synergetyki. Iwasa i in. [2004] wykazali, że zastosowanie neonikotynoidu wraz z synergetykiem zwiększało toksyczność pestycydu dla pszczół nawet tysiąckrotnie (tab. 2).
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Efekty subletalne
Liczne publikacje wykazały, że narażenie pszczół na działanie neonikotynoidów w dawkach subletalnych (nieprowadzących do śmierci) może powodować szereg poważnych zmian w funkcjonowaniu pszczoły miodnej. Większość analiz dotyczyła wpływu neonikotynoidów (głównie imidaklopridu) na zachowanie pszczół, w szczególności ich oddziaływania na żerowanie, kluczowy aspekt sprawności kolonii.
Długotrwałe narażenie na imidakloprid zaburza pozyskiwanie pokarmu [Decourtye i in. 2004] i opóźnia powrót zbieraczek do ula [Fischer i in. 2014; Yang i in. 2008]. Ponadto upośledza uczenie się pszczół oraz ich pamięć wizualną i węchową [Decourtye i in. 2004; Han i in. 2010; Williamson i Wright 2013] – procesy istotne dla wydajności żerowania.
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów

fot. Pixabay, GLady
Tiakloprid, imidakloprid oraz klotianidyna wpływają negatywnie na układ immunologiczny pszczół, osłabiając jego działanie. Należy pamiętać, że silna ochrona immunologiczna ma kluczowe znaczenie dla zdrowia robotnic i przetrwania kolonii.
Osłabienie może spowodować zwiększenie podatności owadów na pasożyty i patogeny [Brandt i in. 2016]. Pettis [2012] dowiódł, że ekspozycja pszczół na imidakloprid zwiększa poziom porażenia pasożytami jelitowymi Nosema sp.
Spadek zdolności do reprodukcji może mieć dla rodziny pszczelej znacznie dotkliwsze skutki niż utrata starszych zbieraczek [Decourtye i Devillers 2010]. Szereg badań wykazał, że imidakloprid wpływał negatywnie na rozwój larwalny pszczół [Abbott i in. 2008; Decourtye i in. 2005; Gregorc i Ellis 2011; Tasei i in. 2000, 2001].
Przykładowo zaobserwowano wydłużenie okresu larwalnego u larw karmionych pokarmem zawierających imidakloprid [Decourtye i in. 2005].
Przytoczone powyżej informacje są powodem, dla którego niskie stężenia neonikotynoidów w pyłku i nektarze (niższe niż LD50; Blacquière i in. 2012) nie mogą być argumentem dla zwolenników stosowania tej grupy środków ochrony roślin.
Ponadto warto podkreślić fakt, iż przytoczone analizy opierały się w głównej mierze na krótkoterminowej podaży neonikotynoidów. Należy jednak pamiętać, że długotrwałe (chroniczne) narażenie organizmu na działanie substancji toksycznej w dawce subletalnej może wywoływać znacznie poważniejsze zmiany w jego funkcjonowaniu.
Sprawa nie jest tak jednoznaczna
Neonikotynoidy dzięki zdolności do translokacji mogą przenikać z nasion do części nadziemnych roślin, także do pyłku i nektaru. Przykładowo w doświadczeniu prowadzonym na słoneczniku nasiona tej rośliny były traktowane imidaklopridem w stężeniu 0,7 mg na nasiono.
W pyłku zebranym ze słoneczników wykazano średnią zawartość insektycydu w stężeniu 3,9 mg/kg nasion, natomiast w zebranym nektarze średnio 1,9 mg/kg nektaru [Schmuck i in. 2001].
Zwolennicy stosowania neonikotynoidów wskazują, że aby pszczoła została narażona na dawkę LD50 tego pestycydu (patrz tab. 1) musiałaby spożyć w krótkim czasie ok. 1,7 g pyłku lub ok. 3,7 g nektaru, czyli znacznie więcej niż sama waży [Howis i Nowakowski 2010].
Należy również wspomnieć, że translokacja neonikotynoidów do pyłku i nektaru roślin z nasion nie jest obserwowana w każdym przypadku [Schmuck i in. 2001].
Większość analiz nie wykazała obecności neonikotynoidów w ciele pszczół. Jednakże głównym powodem tego może być szybki metabolizm tych pestycydów (powstałe w tym procesie metabolity również są toksyczne).. Ponadto większość analiz nie uwzględnia zawartości metabolitów pestycydów [Blacquière i in. 2012].
Analiza metabolitów imidaklopridu wykazała ich obecność w 18,7% wszystkich badanych pszczół [Chauzat i in. 2011].
Istnieją rozbieżności pomiędzy wynikami uzyskanymi w badaniach laboratoryjnych oraz polowych. Na przykład Cutler i Scott-Dupree [2007] nie zgłosili żadnych zaburzeń w zachowaniu pszczół narażonych na kontakt z rzepakiem, którego nasiona potraktowano neonikotynoidem.
W opracowaniu dla „Science” prof. Dave Goulson [2018] zasugerował, że wyniki badań prowadzonych przez koncerny produkujące neonikotynoidy mogą być celowo mylące.
dr Agata Bednarek, mgr Łukasz Nicewicz
Katedra Fizjologii Zwierząt i Ekotoksykologii, Uniwersytet Śląski w Katowicach
<?php $pas="2018nr5str20"; $pasCov="images/stories/Pasieka/2018_5/Pasieka_2018nr05_[91].jpg"; include("./goto/art_footer.php"); ?>



