UWAGA! Artykuł pochodzi ze starych wydań Pasieki. Część wiedzy może być już nieaktualna.
Pamiętaj by zawsze sprawdzić informacje w nowszych numerach "Pasieki". Wiele informacji z zakresu leczenia pszczół lub gospodarki pasiecznej uległo zmianie. Informacje zawarte w tym artykule utrzymujemy na stronie w ramach archiwizacji wiedzy pszczelarskiej.
Zwalczyłem warrozę, a i tak mam puste ule
Wielu pszczelarzy zastanawia się co może być przyczyną upadku dużej liczby rodzin pszczelich w ich pasiekach. Zwłaszcza wówczas, kiedy starannie i terminowo zwalczali Varroa destructor, a przygotowania do zimowli zakończyli w pierwszych dniach września.
Mimo to, pod koniec zimy lub wczesną wiosną rodziny słabną i osypują się przy pełnych plastrach pożywienia.

Fot. 1. Nosemoza może być przyczyną dużych strat w pasiekach.
fot.© Dariusz Karwan
Cichy zabójca – skąd się pojawił?
Nie możemy wszystkich upadków rodzin pszczelich zrzucać na barki CCD, choć niewykluczone, że za wieloma przypadkami utraty rodzin pszczelich stoi właśnie „Zespół masowego ginięcia pszczół miodnych”. Jednak mechanizm CCD jest nieco odmienny niż ostatnie doniesienia pszczelarzy.
Najprawdopodobniej za taki stan rzeczy jest odpowiedzialna nosemoza (nosemosis apium), (zdj. nr 1). Pisałem już wcześniej o tej jednostce chorobowej, jednak obecnie mamy do czynienia nie z Nosema apis, a nowym pasożytem z rodzaju Nosema, tj. Nosema ceranae.
Ciekawostką jest fakt, iż po raz pierwszy zdiagnozowano i opisano zarażenie pszczoły miodnej (Apis mellifera L.) Nosema ceranae w 2005 roku u pszczół z Tajwanu oraz z Hiszpanii. W naszym kraju pierwsze doniesienia o zakażeniu tym pasożytem odnotowano dwa lata później.
Jednak trzeba podkreślić, iż obecność spor N. Ceranae potwierdzono w próbkach zebranych w 1995 r. Należy zatem zadać pytanie, dlaczego wcześniej nie obserwowano takich upadków rodzin pszczelich jak obecnie? Przyczyn takiego stanu rzeczy może być parę, ale wydaje się, że dwa zasadnicze aspekty wyjaśniają ten stan rzeczy.
Po pierwsze, w Polsce oraz w innych krajach europejskich zakazano stosowania fumagiliny. Drugim czynnikiem mogącym przyczyniać się do rozprzestrzeniania się choroby jest stan środowiska naturalnego. Mimo uregulowań prawnych, problemem jest niewłaściwe stosowanie środków ochrony roślin przez sadowników i rolników, czym doprowadzają do znacznego skażenia środowiska naturalnego pestycydami.
W Stanach Zjednoczonych w 108 różnych próbach przebadanego pyłku, aż w 46 wykryto różnego rodzaju pestycydy. W próbie pyłku pochodzącego od 1 rodziny pszczelej stwierdzono obecność aż 17 pestycydów, zaś w próbie pszczół – 24 pestycydy.
Podobnie rzecz się ma w Europie, we Francji stwierdzono 19 pestycydów w badanych próbach pyłku, a najczęściej występującym związkiem był imidachlopryd (w 49% prób z 81 pobranych). W miodach hiszpańskich przy użyciu metody chromatografii gazowo-cieczowej, zidentyfikowano węglowodory fosforoorganiczne.
Wykazano, że 25-50% próbek miodu zawierało pozostałości pestycydów fosforoorganicznych.
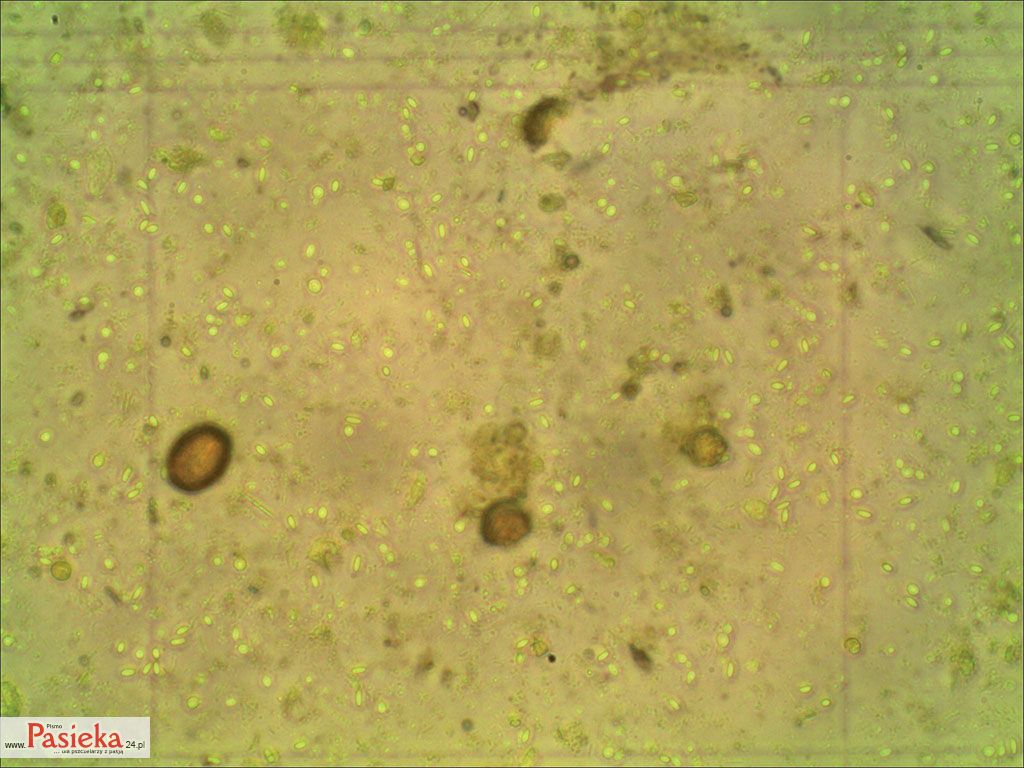
Fot 2. Spory Nosemosis widoczne pod mikroskopem.
fot.© Dariusz Karwan
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Objawy i drogi zarażenia
Wspomniani wcześniej naukowcy hiszpańscy, jako pierwsi w Europie odkryli N. ceranae u Apis meliffera i odkryli cztery fazy zarażenia. Faza pierwsza jest bezobjawowa. Liczba zarażonych zbieraczek nie przekracza 65%, a liczba spor przypadających na jedną pszczołę waha się w granicach 106.
Faza druga jest bardziej złożona i powinna zaalarmować pszczelarza. Czasami nazywa się tę fazę, wyrównawczą lub wyrównania siły rodziny. Pojawia się jesienią lub zimą w czasie, kiedy czerwiu w rodzinach nie powinno już być.
Jednak w rodzinach chorych matka chcąc wyrównać straty pszczół, czerwi bardzo intensywnie. Jest to pierwszy widoczny sygnał, który może świadczyć, że coś niepokojącego dzieje się z naszymi rodzinami. Trzecią fazą jest tzw. fałszywe ozdrowienie i ma miejsce wiosną, kiedy w rodzinie pszczelej zaczyna przybywać pszczół.
Jednak rodziny zarażone są „ospałe” i mimo dużej liczby pszczół produkcyjność jest bardzo mała. Czasami, podczas przeglądów takiej rodziny można mieć wrażenie, że będzie się roić – jednak rójka nigdy nie nastąpi. Czwarta faza, to agonia rodziny pszczelej.
Intensywne czerwienie kończy się nagle jesienią lub wczesną wiosną następnego roku i rodzina osypuje się posiadając nierzadko pełne plastry pożywienia. Stopień zarażenia zbieraczek jest bardzo wysoki i wynosi powyżej 65%, a ilość spor na jedną pszczołę jest wyższa od 106.
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Z mojego podwórka
Na zdjęciu nr 2 [fot 2] widać spory, które pochodzą z mojej pasieki, a próbka została pobrana i przygotowana w roku 2014 z osypu zimowego. Następnie pod mikroskopem obserwowano i sfotografowano rozmiar choroby. Ku mojemu zdziwieniu, ponieważ nie zauważyłem żadnych zmian w wydajności lub zachowaniu rodzin pszczelich.
Diagnoza była jednak bezlitosna i działanie musiało być natychmiastowe i bardzo skuteczne. Moim pierwszym pomysłem była wspomniana fumagilina, ale od razu pomyślałem o zakazie jej stosowania i możliwości skażenia produktów pszczelich, których nie mógłbym sprzedać. Należało więc szukać innego rozwiązania, dozwolonego w naszych pasiekach.
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów

Fot. 3. Przygotowany dla pszczół syrop cukrowy (z dodatkiem Nozewitu).
fot.© Dariusz Karwan
Czas wrócić do natury – leczenie
Sama natura przychodzi nam tutaj z pomocą, pamiętajmy bowiem, że każdy sztucznie wytworzony specyfik z biegiem lat jest mniej skuteczny. Dzieje się tak m.in. dlatego, że patogeny chorobotwórcze na drodze selekcji przystosowują się do substancji, które je zabijają.
Natomiast substancje pochodzące z samej natury nie są „postrzegane” przez patogeny jako trucizny i nie potrafią się na nie uodpornić (pod warunkiem spełnienia paru zasad).
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Innym bardzo dobrym rozwiązaniem jest wyciąg z czosnku aplikowany pszczołom w niewielkich dawkach syropu (ok. 0,5 l/ul). Na jedną rodzinę stosujemy wówczas ok. 1 ml podczas jednej aplikacji. Całą procedurę należy powtórzyć 2-3 razy w odstępach ok. 7-10 dni.
Mankamentem takiej kuracji jest fakt dość nieprzyjemnego i bardzo intensywnego zapachu w ulach, dlatego takie rozwiązanie może być stosowane po ostatnim miodobraniu lub bardzo wczesną wiosną na co najmniej 30 dni przed pierwszym pożytkiem towarowym.
Poza tym, bardzo ważnym aspektem jest pochodzenie samego warzywa. Najlepiej kiedy wyrosło ono w naszym ogrodzie i uprawiane było bez użycia chemii. Innymi rozwiązaniami są przedstawione na 52 Naukowej Konferencji Pszczelarskiej w Puławach zabiegi z użyciem kofeiny, koenzymu Q10, kurkuminy i kapsaicyny.
Po uzyskaniu wstępnych wyników, naukowcy prowadzący te badania stwierdzili, iż zwłaszcza kofeina i kurkumina są najbardziej obiecującymi substancjami w walce z chorobą. Substancje te wydłużają znacznie życie pszczół, a ilość spor w ich organizmach znacząco spada.
Prowadzone są również badania naukowe z użyciem nadtlenku wodoru (H2O2) w stężeniu 3%, czyli tzw. wodą utlenioną.
Podsumowanie
Nie miałem na celu przedstawianie całego procesu namnażania nosemosis, a jedynie wskazanie na nowego wroga pszczół oraz wskazanie pewnych rozwiązań leczniczych. Jednak zanim przystąpimy do walki z tą bardzo groźną zaraźliwą chorobą, jak zawsze, zdiagnozujmy najpierw liczebność przeciwnika.
Dopiero rzetelna wiedza na temat rozmiaru zarażenia pozwoli nam na skuteczną walkę. Typowe prace hodowlane, takie jak coroczna wymiana matek lub zachowanie higieny, czyli wymiana plastrów na nowe w każdym sezonie, przesiedlanie rodzin do czystych uli nie rzadziej jak co trzy sezony, pozwolą na zachowanie wysokiej zdrowotności naszych podopiecznych i uzyskania dużych zbiorów produktów pszczelich.
Dodam, iż zbliża się najwłaściwszy czas, kiedy podczas wymiany dennic, należy pobrać próbki pszczół z osypu zimowego i je przebadać. Wydatek finansowy takiej operacji jest minimalny, a zyski mogą być spore.
Dariusz Karwan
Bibliografia
- Chauzat M.P., Faucon J.P., Martel A.C., Lachaize J., Cougoule N., Aubert M., (2006). A survey of pesticide residues in pollen loads collected by honey bees in France. J. Econ. Entomol., 99 (2): 253-262.
- Paxton R. J., (2010). Does infection by Nosema ceranae cause Colony Collapse Disorder in Honey bees (Apis mellifera)? Journal of Apicultural Science, 49(1): s. 80-84.
- Garcia J., Rodrigez R. I., Crescente R. P., Garcia J. B., Garcia Martin S., Latorre C. H. (2006). Preliminary Chemometric Study on the Use of Honey as an Environmental Marker in Galicia (Northwestern Spain). J. Agric. Food Chem.: s. 7206-7212.
- Paxton R., Klee J., Korpela S., Fries I. (2007). Nosema ceranae has infected Apis mellifera in Europe since at least 1998 and may be more virulent than Nosema apis. Apidologie, 38, 558-565.
- Pohorecka K. (2004). Choroby pszczół wywołane przez pierwotniaki, w: Podstawowe zasady diagnostyki, zwalczania i profilaktyki chorób czerwia i pszczół w aspekcie obrotu produktami pszczelimi – materiały szkoleniowe. Puławy: 27-46.
- Suchail S., Guez D., Belzunces L.P. (2001). Discrepancy between acute and chronic toxicity induced by imidacloprid and its metabolities in Apis mellifera. Environ. Toxicol. Chem. 20(11): 2482-2486.
- Aliouane Y., Hassani A.K., Gary V. Armengaud C., Lamin L., Gautier M., (2008). Subchronic expo-sure of honeybee to sublethal doses of pesticides effects on behavior. Environ. Toxicol. Chem.: 113-122.
- Chorbiński P. (2012). Pokonaj warrozę. Wyd. II, poszerzone. Bee & Honey sp. z.o.o. Kęty.
- Topolska G., Hartwing A. (2005). Diagnosis of Nosema apis infection by investigations of two kinds of samples: dead bees and live bees. Journal of Apicultural Science, 49(2): s.75-79.
- Sokół R., Michalczyk M. (2012). Detections of nesema spp. In worker bees of different ages during the flow season. Journal of Apicultural Science, 56(2): s. 19-25.
- Gliński Z., Jarosz J. (1995). Immunobiologia pszczoły miodnej. Wydawnictwo AR. Lublin 1995.
- Schulz M., Strachecka A., Olszewski K., Paleolog J. Wpływ suplementów diety pszczoły miodnej (Apis mellifera carnica) na zakażenia Nosema spp. - 52 Naukowa Konferencja Pszczelarska. Puławy 2015: s. 40-41.
<?php $pas="2016nr2str14"; $pasCov="images/stories/Pasieka/2016_2/Pasieka_2016nr02_[76].jpg"; include("./goto/art_footer.php"); ?>



