Nosemoza typu A i typu C – kilka najnowszych badań
Obecnie w Polsce występują dwa gatunki pasożytniczych grzybów wywołujących nosemozę: Nosema apis (wywołująca nosemozę typu A) oraz Nosema ceranae (powodująca nosemozę typu C). Podczas gdy nosemoza pierwszego typu daje ewidentne objawy w postaci zanieczyszczenia kałem wlotków i ula, to rozpoznanie występowania nosemozy typu C jest bardzo trudne. W zeszłym roku opracowano sporo wyników badań naukowych, które pozwalają lepiej zrozumieć oba typy choroby oraz dają nadzieję na nowe możliwości leczenia.
Nosema – cykl życia
Nosemy to diploidalne eukarionty rozmnażające się w sposób bezpłciowy. Zakwalifikowano je do królestwa grzybów. Są wyspecjalizowane do życia na innych eukariontach. Gruba ściana komórkowa zarodników powoduje, że są one bardzo trudne do zniszczenia i mogą przetrwać w środowisku zewnętrznym kilka lat.

fot.© Roman Dudzik
W części szczytowej spory ściana jest trochę cieńsza. Znajduje się tam aparat ekstruzyjny wyrzucający nić biegunową (włókno biegunowe), która wbija się w atakowaną komórkę. Przez nić do komórki przedostaje się sporoplazma, która zawiera m.in. dwa sprzężone jądra Nosemy. Będąc wewnątrz komórki gospodarza sporoplazma dzieli się i mnoży, aż w końcu powstają spory gotowe atakować kolejne komórki. Pasożyt może kontynuować namnażanie wewnątrz żywiciela lub zostać wydalony z kałem (Ptaszyńska i Mułenko, 2013).
Oba typy nosemozy rozwijają się głównie wewnątrz komórek nabłonka jelita środkowego pszczół dorosłych, ale mogą też rozprzestrzeniać się w ciele żywiciela. Nosema ceranae stwierdzono również w innych tkankach owadów, np. gruczołach gardzielowych lub w ciele tłuszczowym, podczas gdy N. apis zazwyczaj ogranicza się do jelita środkowego (Chen i in. 2009, Gisder i in. 2010).Oba typy nosemozy powodują u pszczół problem z orientacją, trudności ze znalezieniem drogi do ula, immunosupresję (hamowanie wytwarzania komórek odpornościowych) oraz stres energetyczny.
Nosema typu C atakuje nie tylko Apis mellifera i A. ceranae, lecz również A. dorsata, A. florea i A. koschenikovi, a także niektóre gatunki trzmieli, które są odporne na N. apis. Do zarażenia robotnic przez N. ceranae wystarczy od 20 do 90 zarodników grzyba, a matka zapada na chorobę, gdy do jej organizmu przedostanie się ok. 1000 zarodników. Skład zapachowy substancji matecznej porażonej matki zmienia się, co czasem prowadzi do jej cichej wymiany. W dodatku nosemoza powoduje zmiany w fizjologii jajników i matka staje się bezpłodna.
Składa porażone jaja, które są zjadane przez robotnice – w rodzinie pojawia się czerw rozstrzelony (Ptaszyńska i Mułenko, 2013). Spory nosemoz mogą dostać się do organizmu pszczół poprzez:
- a) pobranie zarodników wraz z nektarem kwiatów i spadzią
- b) spożycie zakażonego kału (z powodu złej pracy porażonego jelita nie wszystkie cukry są trawione i fekalia są słodkie, co zachęca inne robotnice do ich zlizywania)
- c) zarażenia matki pszczelej przez spermę trutni
- d) karmienie zdrowych larw przez chore robotnice
- e) trofolaksja
- f) składanie przez matkę zarażonych jaj
Przebieg choroby
Objawy chorobowe nosemozy typu A na pierwszy rzut oka wyglądają groźniej niż typu C, ale to właśnie ta druga forma jest poważniejsza, również z powodu utrudnionego rozpoznania.
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów

W przypadku suchej nosemozy pszczoły osypują się zazwyczaj na wiosnę.
fot.© Roman Dudzik
Wpływ nosemozy na organizm pszczoły
Ponieważ zdewastowane jelito środkowe pszczół nie wchłania pokarmu w odpowiednim stopniu, to porażone osobniki głodują. Powoduje to również wzrost konsumpcji cukrów przez porażone robotnice (Mayack i Naung, 2009). W dodatku spory Nosemy mają szczątkowe mitochondria, dlatego pobierają ATP (koenzym biorący udział w wewnątrzkomórkowym transporcie energii) bezpośrednio z komórek żywiciela osłabiając go (Williams 2009).
Z tego powodu pszczoły cierpią na stres energetyczny. Pszczoły próbują wyrównać braki w „dostawach energii” poprzez wzrost spożycia pokarmów. Nosema ceranae wpływa także na wzrost wydzielania oleinianu etylu, który jest głównym składnikiem kompozycji feromonowej wydzielanej przez pszczoły.
Powoduje to opóźnienie zmiany pszczół karmicielek w zbieraczki zaburzając homeostazę gniazda i sprawiają, że pszczoły są bardziej narażone na stresy środowiskowe (Dussaubat i in. 2010).
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Nauka przeciwko nosemozie
Duńscy hodowcy z Queen Breeders Association wyselekcjonowali linię pszczół tolerancyjną na nosemozę (Hatjina i in. 2014 r.). Stopień porażenia rodzin pszczelich z tej linii nie przekracza 10% (u „zwykłych” ras pszczół porażenie osiąga zazwyczaj od 60 do 80%).
Mechanizm obronny systemu odpornościowego w jelitach owadów polega na produkcji białek antybakteryjnych oraz reaktywnych form tlenu (RFT) i azotu (RFA). Jedno z tych białek (peroksydaza tioredoksynowa) występuje bardzo obficie u duńskich pszczół tolerancyjnych na nosemozę.
Ta peroksydaza spełnia bardzo ważną rolę w przeciwdziałaniu stresowi oksydacyjnemu, który pojawia się, gdy organizm pszczoły wydziela RFT do walki z pasożytem. To sugeruje, że reaktywne formy tlenu są zaangażowane w ochronę przeciwko N. ceranae.
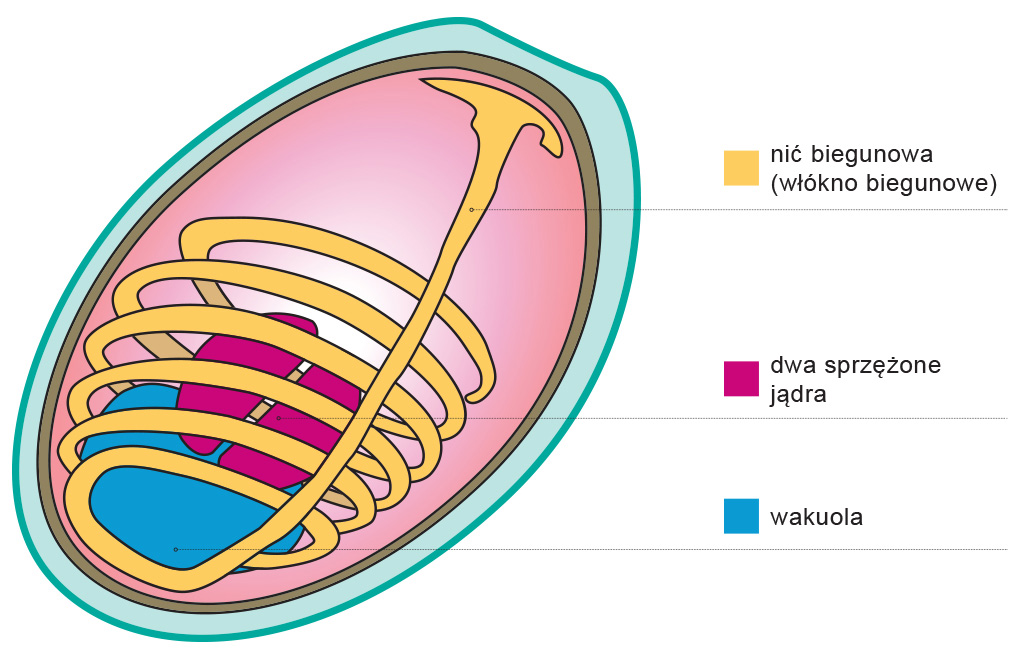
Schemat budowy zarodnika Nosema wykonany na podstawie ilustracji zawartej w artykule “Wybrane aspekty budowy, taksonomii oraz biologii rozwoju mikrosporydiów z rodzaju Nosema“, Aneta A. Ptaszyńska, Wiesław Mułenko
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Martyna Walerowicz
W następnym numerze „Pasieki” ukaże się artykuł dotyczący ras pszczół odpornych na nosemozę i zasad sprowadzania do Polski nowych linii A. mellifera wyhodowanych na terenie Unii Europejskiej.
Literatura
- Chen Y. P., Evans J. D., Murphy C., Gutell R., Zuker M., Gundensen-Rindal D., Pettis J. S.: Morphological, molecular, and phylogenetic characterization of Nosema ceranae, a microsporidian parasite isolated from the European honey bee, Apis mellifera. J. Eukaryot. Microbiol. 2009, 56, 142-147.
- Corby-Harris V. L. Snyder, C. A. D. Meador, R. Naldo, B. Mott, i K. E. Anderson. Parasaccharibacter apium, gen. nov., sp. nov., Improves Honey Bee (Hymenoptera: Apidae) Resistance to NosemaJournal of Economic Entomology, 109(2), 2016, 537–543
- Dosselli R., Grassl J., Carson A., Simmons L. i Baer B. Flight behaviour of honey bee (Apis mellifera) workers is altered by initial infections of the fungal parasite Nosema apis. Scientific reports. 2016.
- Dussaubat, C., Maisonnasse, A., Alaux, C., Tchamitchan, S., Brunet, J.L., Plettner, E., Belzunces, L.P., Le Conte, Y., 2010. Nosema spp. infection alters pheromone production in honey bees (Apis mellifera). J. Chem. Ecol. 36, 522–525.
- Dussaubat C., Maisonnasse A., Crauser D., Beslay D., Costagliola G., Soubeyrand S., Kretzchmar A., Le Conte Y. Flight behavior and pheromone changes associated to Nosema ceranae infection of honey bee workers (Apis mellifera) in field conditions. 2013. Journal of Invertebrate Pathology 113, 42–51
- Gajda A., Nosema ceranae w rodzinach pszczoły miodnej. Życie Weterynaryjne, 2010, 85(2), 140-143.
- Gisder S., Hedtke K., Möckel N., Frielitz M. C., Linde A., Genersch E.: Five-year cohort study of Nosema spp. in Germany: does climate shape virulence and assertiveness of Nosema ceranae? Appl. Environ. Microbiol. 2010, 76, 3032-3038.
- Hatjina, F., Bienkowska, M., Charistos, L., Chlebo, R., Costa, C., Dra#zi#c, M.M., Filipi, J., Gregorc, A., Ivanova, E.N., Kezi#c, N., Kopernicky, J., Kryger, P., Lodesani, M., Lokar, V., Mladenovic, M., Panasiuk, B., Petrov, P., Rai, S., Smodis Skerl, M.I., Vejsns, F.,Wilde, J., 2014. A review of methods used in some European countries for assessing the quality of honey bee queens through their physical characters and the performance of their colonies. J. Apic. Res. 53, 337e363.
- Higes M., Martin-Hernandez R., Botias C., Garrido-Bailon E., Gonzalez-Porto A., Barrios L., del Nozal M., Bernal J., Jimenez J., Garcia- Palencia P., Meana A.: How natural infection by Nosema ceranae causes honeybee colony collapse. Environm. Microbiol. 2008, 10, 2659-2669.
- Kurze C., Dosselli R., Grassl J., Le Conte Y., Kryger P., Baer B., Moritz R. F. A. Differential proteomics reveals novel insights into Nosemaehoney bee interactions. Insect Biochemistry and Molecular Biology. 2016, 79, 42-49
- Mayack, C., Naug, D., 2009. Energetic stress in the honeybee Apis mellifera from Nosema ceranae infection. J. Invertebr. Pathol. 100, 185–188.
- Peng Y., Grassl J., Millar A.H., Baer B. Seminal fluid of honeybees contains multiple mechanisms to combat infections of the sexually transmitted pathogen Nosema apis. Proc. R. Soc. 2016 B 283
- Ptaszyńska A., Mułenko W., Wybrane aspekty budowy, taksonomii oraz biologii rozwoju mikrosporydiów z rodzaju Nosema. Medycyna Weterynaryjna. 2013. 69(12)
- Williams, B.A.P., 2009. Unique physiology of host-parasite interactions in Microsporidia infections. Cell Microbiol. 11, 1551e1560.
<?php $pas="2017nr3str34"; $pasCov="images/stories/Pasieka/2017_3/Pasieka_2017nr03_[83].jpg"; include("./goto/art_footer.php"); ?>



