Agata Nicewicz, Łukasz Nicewicz
Białka i aktywność enzymatyczna w miodzie
Miód to mieszanina co najmniej 181 różnych substancji [Alvarez-Suarez i wsp., 2010]. Mniej oczywistymi składnikami tego cennego produktu wytwarzanego przez pszczoły są białka i aminokwasy (cegiełki budujące białka), które stanowią, według różnych źródeł, od 0,58 do nawet (w skrajnych przypadkach) 7,86% [White, 1978].

Fot. Roman Dudzik
Frakcja białkowa dominuje ilościowo nad aminokwasami – stanowi od 40 do 80% wszystkich związków azotowych w miodzie. Obecność białek powoduje, że miód ma niższe napięcie powierzchniowe, co determinuje wyraźną tendencję do pienienia się i tworzenia kożucha oraz sprzyja tworzeniu się drobnych pęcherzyków powietrza [Di Girolamo i wsp., 2012].
Miód gryczany cechuje się najwyższą zawartością białek, a najniższą – miód akacjowy czy lipowy [Erban i wsp., 2019]. Wieloletnie eksperymenty wykazały, że zawartość białka w miodzie spada o 46,7% po 6 miesiącach, niezależnie od pochodzenia botanicznego [Brudzynski i wsp., 2013].
Źródłem pochodzenia białek i aminokwasów w miodzie są same pszczoły – związki te wydzielane są przez gruczoły ślinowe i gardzielowe zbieraczek, a także rośliny – a właściwie pyłek, który znajduje się w miodzie [Lewkowski i wsp., 2019]. Białka roślinne są rzadko wykrywane w profilach białkowych miodu (z wyjątkiem miodu gryczanego, eukaliptusowego, słonecznikowego i rzepakowego). Zwykle stanowią niewielki ułamek całkowitej zawartości białka, ponieważ mogą być trawione przez proteazy pszczoły miodnej, filtrowane (cząsteczki pyłku) lub rozkładane podczas dojrzewania miodu [Baroni i wsp., 2002; Di Girolamo i wsp., 2012; Erban i wsp., 2019]. Przechowywanie białek wyprodukowanych przez pszczoły w miodzie zapobiega lub co najmniej silnie spowalnia degradację tych związków chemicznych. Zapewnia zatem alternatywne ich przechowywanie, w porównaniu do bezpośredniego w tkance wydzielniczej (gruczole) lub w hemolimfie [Lewkowski i wsp., 2019].
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Aminokwasy
Aminokwasy pełnią istotną funkcję – są prekursorami (cegiełkami) budującymi białka, które są niezbędnym elementem tworzącym organizm. W miodzie obecnych jest 26 aminokwasów, które stanowią od 0,1% do 1% ww. Spośród nich dominuje prolina, która stanowi ok. 50–85% wszystkich aminokwasów. Zawartość pozostałych 25 aminokwasów oraz ich względne proporcje (tzw. profil aminokwasowy) zależą od pochodzenia miodu (nektar lub spadź). Jednak większość miodów gatunkowych cechuje się wysoką zawartością fenyloalaniny, kwasu asparaginowego oraz kwasu glutaminowego. Miód tymiankowy cechuje się wysoką zawartością seryny, tyrozyny i lizyny. W miodzie rozmarynowym głównym aminokwasem jest tyrozyna, obecne są także duże ilości proliny i fenyloalaniny [Hermosı́n i wsp., 2003].
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Enzymy metabolizmu węglowodanów
Istotną częścią frakcji białkowej miodu są enzymy, które jednocześnie stanowią jeden z najważniejszych składników miodu w ogóle. Ich głównym zadaniem jest konwersja nektaru i spadzi w miód, a tym samym odpowiedzialne są za powstawanie miodu. W wyniku reakcji enzymatycznych w nektarze powstaje szeroka gama związków, które nadają niepowtarzalny charakter i funkcjonalność temu produktowi pszczelemu. Skomplikowany profil węglowodanowy miodu jest częściowo wynikiem działania enzymatycznego [Codex Alimentarius, 1994; Oddo i Pulcini, 1999].
Większość enzymów zawartych w miodzie jest pochodzenia zwierzęcego – wydzielane są przez gruczoły ślinowe i gardzielowe robotnic, i dodawane w trakcie przekazywaniu nektaru pomiędzy pszczołami. A zatem ilość enzymów obecnych w miodzie zależna jest od stanu fizjologicznego pszczół, siły rodziny, temperatury ula czy przepływu nektaru. Do tej grupy enzymów zaliczamy: α- i β-glukozydaza (inwertaza) – stanowiące nawet do 50% białek wydzielanych przez gruczoły gardzielowe pszczół, α- i β-amylaza (diastaza) oraz oksydaza glukozowa – stanowiące do 3% białek wydzielanych przez gruczoły gardzielowe pszczół [Babacan i Rand, 2006; Chua i wsp., 2013; Pontoh i Low, 2002; Won i wsp., 2008]. Aktywność α- i β-glukozydazy, α- i β-amylazy wraz z poziomem hydroksymetylofurfuralem (HMF) wykorzystywane są do oceny przegrzania miodu. Choć stabilność termiczna α- i β-amylaz jest wyższa niż α- i β-glukozydaz [Berlitz i wsp., 2009].
Inwertazy (α- i β-glukozydazy) to enzymy rozkładające sacharozę i maltozę do cukrów prostych (glukozy i fruktozy) – głównego składnika miodu. Katalizują one główną reakcję, która powoduje dojrzewanie nektaru do miodu. Inwertaza umożliwia pszczołom wytwarzanie bardzo skoncentrowanego roztworu cukrów, odpornego na fermentację, będącego wysokoenergetycznym środkiem spożywczym zajmującym minimalną powierzchnię w plastrze miodu [Sánchez i wsp., 2001].
Inwertazy są bardzo wrażliwe na przechowywanie i ogrzewanie miodu (np. w celu dekrystalizacji), bardziej niż diastazy. Podgrzanie miodu lub zalanie go płynem o temperaturze równej, lub wyższej niż 50°C powoduje znaczącą redukcję ich aktywności [Dimins i wsp., 2014]. Dlatego w niektórych krajach pomiar aktywności inwertaz wskazuje na świeżość miodu oraz prawidłowe warunki jego przechowywania. Aktywność inwertazy jest wyrażana jako liczba inwertazy (jednostki Hadorna), która wskazuje na ilość aktywnego enzymu zawartego w miodzie, który rozkłada sacharozę (wyrażoną w gramach) w ciągu 1 godziny przez enzym obecny w 100 g miodu w warunkach testowych [Hadorn i Zürcher, 1966]. Świeże i niezafałszowane miody cechują się co najmniej 10 jednostkami Hadorna, podczas gdy miody o niskiej aktywności enzymatycznej powinny mieć co najmniej 4 jednostki [Berlitz i wsp., 2009]. Miody spadziowe cechują się wysoką aktywnością inwertaz, a miód akacjowy najniższą aktywnością tej grupy enzymów [Oddo i wsp., 1999]. W Polsce nie stosuje się pomiaru aktywności inwertaz do oceny świeżości miodów.
Diastazy (α- i β-amylazy) odpowiedzialne są za rozkład wielocukrów, w tym rozkładu skrobi do maltozy. Co ciekawe, w miodzie naturalnym nie występują cukry złożone. Stąd też celowość obecności diastazy w miodzie nie została wyjaśniona. Prawdopodobnie enzym ten ma istotne znaczenie dla rozwoju młodych pszczół, a nie w procesie dojrzewania miodu [Wesołowska i Dźugam, 2017]. Enzymy te są stosunkowo stabilne przy podgrzewaniu i przechowywaniu miodu. Jednakże podgrzewanie miodu w temperaturze powyżej 45°C powoduje drastyczne obniżenie aktywności tych enzymów [Kowalski i wsp., 2012]. Dlatego też są m.in. wskaźnikiem świeżości miodu.
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Jednak najistotniejszym enzymem, który dzięki swojej aktywności nadaje właściwości antybakteryjnych miodowi, jest oksydaza glukozowa. Jest to enzym, który pszczoły dodają do nektaru w trakcie procesu produkcji miodu. Katalizuje on reakcje przekształcenia glukozy obecnej w nektarze do kwasu glukonowego w obecności tlenu i wody (Ryc. 1).
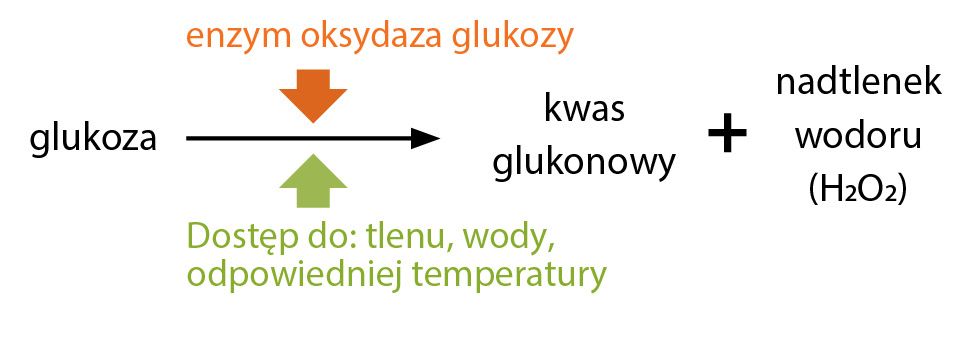
Ryc. 1. Schemat powstawania nadtlenku wodoru z glukozy. Istotnymi czynnikami, niezbędnymi do przeprowadzenia reakcji są: obecność enzymu, dostępu do tlenu, wody i odpowiednia temperatura środowiska reakcji. Na podstawie: Kędzia i Hołderna-Kędzia, 2017; White [1966].
Produktem ubocznym tej reakcji jest nadtlenek wodoru (H2O2). Produkty tej reakcji (kwas oraz H2O2) chronią miód przed zanieczyszczeniem drobnoustrojami podczas dojrzewania. Nadtlenek wodoru zawarty w miodzie pełni także inną funkcję, znacznie istotniejszą dla potencjalnych konsumentów – odpowiada za jego aktywność biobójczą względem bakterii, wirusów, grzybów czy pierwotniaków. Badania wykazały, że cząsteczki H2O2 mogą przenikać przez błony komórkowe wielu patogenów, gdzie następnie są rozkładane przez systemy ochronne gospodarza. Jednakże, w wyniku tego procesu, z niszczonej cząsteczki nadtlenku wodoru tworzone są wolne rodniki hydroksylowe (HO•). Jak już pisaliśmy w poprzednim artykule („Pasieka” 1/2021), wolne rodniki „odbierają” elektrony innym związkom chemicznym, w tym cząsteczkom DNA, indukując mutacje i uszkodzenie materiału genetycznego gospodarza. Stąd też właściwości biobójcze miodów [Ahmed i wsp., 2018; Dubiago i wsp., 2018; Kędzia i Hołderna-Kędzia, 2017; Rybak-Chmielewska i Szczęsna, 2008; Samarghandian i wsp., 2017; Vallianou, 2014; Żegliński, 2006].
Już niewielkie ilości nadtlenku wodoru działają bakteriostatycznie, czyli ograniczają wzrost bakterii chorobotwórczych: ziarniaków gronkowca złocistego (Staphylococcus aureus) i pałeczek ropy błękitnej (Pseudomonas aeruginosa), która wywołuje zakażenia wewnątrzszpitalne i jest groźna ze względu na oporność na wiele antybiotyków, a także grzybów drożdżoidalnych Candida albicans wywołujących grzybice skóry, paznokci, stóp czy pochwy oraz grzybów pleśniowych Aspergillus fumigatus wywołujących reakcje alergiczne, czy grzybicę uszu [Kędzia i Hołderna-Kędzia, 2017]. Wyższe stężenia H2O2 działają bakteriobójczo [Bucekova i wsp., 2019].
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów

Fot. Roman Dudzik
Istotną kwestią jest także temperatura wody, którą zalewamy miód. Należy pamiętać, że w przypadku rozpuszczania miodu w wodzie chcemy uzyskać jak największą wydajność oksydazy glukozowej, która wyprodukuje duże ilości nadtlenku wodoru. Enzym ten jest białkiem, które narażone jest w wysokich temperaturach na denaturację – niszczenie struktury. Proces ten przypomina ścinanie białka jajka gotowanego na twardo i powoduje utratę właściwości enzymu. Wystarczy 15 min. ogrzewania miodu w temp. 60°C, 5 min w temp. 80°C, a nawet godzinna ekspozycja słoika miodu na słońce, aby doszło do denaturacji oksydazy glukozy i bezpowrotnej utraty właściwości antybiotycznych miodu [Gonnet, 1988]. A zatem trzeba pamiętać, że miód należy przechowywać w chłodnym i ciemnym miejscu, ponieważ aktywność oksydazy glukozy spada w trakcie przechowywania miodu [Krauze i Krauze, 1991]. Dodatkowo należy zwracać uwagę na temperaturę wody, którą zalewamy miód, ponieważ powyżej 41°C rozpoczyna się powolny proces denaturacji białek [Fagain, 1997]. Podgrzanie miodu lub zalanie go płynem o temperaturze równej, lub wyższej niż 55°C powoduje znaczącą redukcję aktywności enzymu oksydazy glukozy [Kretavicius i wsp., 2010].
Zawartość H2O2 w miodach jest zmienna i zależy od botanicznego pochodzenia tego produktu. Miód akacjowy, wrzosowy i rzepakowy należą do miodów, które cechują się niską aktywnością oksydazy glukozowej, a co za tym idzie – niewielką ilością nadtlenku wodoru. Natomiast miód gryczany jest najbogatszy pod względem zawartości H2O2 (2,68 mM H2O2/L miodu). Co interesujące, miód Manuka, pomimo swoich cennych właściwości prozdrowotnych, zawiera 2,5 razy mniej H2O2 niż miód gryczany (ok. 1,04 mM H2O2/L miodu) [Brudzyński i wsp., 2011; Dustmann, 1967]. Najnowsze badania wykazały, że miód ten nie gromadzi wykrywalnych poziomów H2O2 po rozcieńczeniu wodą, a jego działanie przeciwbakteryjne wynika z obecności związku organicznego o nazwie metyloglioksal (MGO) [Kwakman i wsp., 2011]. Metyloglioksal modyfikuje enzym oksydazę glukozy, zmieniając jego budowę oraz trwale go wiążąc, wpływając jednocześnie na redukcję produkcji nadtlenku wodoru [Majtan i wsp., 2014].
Do drugiej grupy enzymów obecnych w miodzie zaliczamy te pochodzenia roślinnego – obecne w pyłku i nektarze: katalazę oraz kwaśną fosfatazę [Alonso-Torre i wsp., 2006; Brudzyński i wsp., 2011]. Katalaza to enzym naturalnie występujący w miodzie. Źródłem enzymu są ziarna pyłku roślin i w mniejszym stopniu – nektar. Ponadto aktywność katalazy miodowej częściowo przypisywana jest drożdżom i innym mikroorganizmom [Huidobro i wsp., 2005].
Poziom H2O2 w miodzie jest zależny od tempa jego powstawania – w wyniku aktywności oksydazy glukozy oraz szybkości, z którą jest rozkładany przez enzym – katalazę [Brudzyński i wsp., 2011)]. Jej działanie polega na rozkładzie nadtlenku wodoru do tlenu i wody (Ryc. 2).
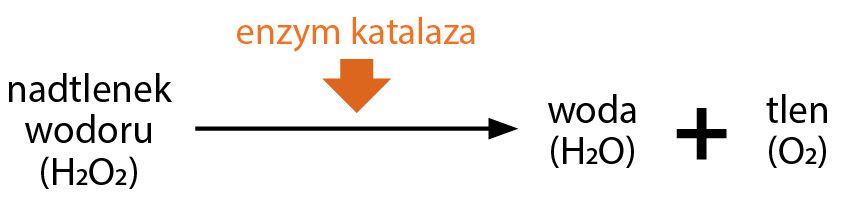
Ryc. 2. Schemat reakcji katalizowanej przez katalazę.
Jest zatem jasne, że bezwzględny poziom H2O2 w każdym miodzie jest określony przez odpowiednie poziomy oksydazy glukozowej i katalazy w tym miodzie. Im wyższy poziom oksydazy glukozowej, tym wyższy poziom nadtlenku wodoru, a im niższy poziom katalazy, tym wyższy poziom nadtlenku wodoru. Co jednak ważne, katalaza obecna w miodzie nie jest w stanie w całości rozłożyć powstającego nadtlenku wodoru [Dustman, 1971; Weston, 2000].
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Białka mleczka pszczelego
Istotnym elementem białkowym miodu są białka mleczka pszczelego [Di Girolamo i wsp., 2012], wydzielane z gruczołów młodych robotnic w celu karmienia larw i matki [Chua i wsp., 2013). Zaliczamy do nich m.in.: główne białka mleczka pszczelego (MRJP) od 1 do 8, z największą ilością MRJP1, defensynę-1 (rojalizyna), hymenoptaecin oraz apisiminę. Białka te są ważne dla aktywności przeciwdrobnoustrojowej miodu, które wraz z innymi związkami chemicznymi wytwarzanymi w trakcie przemian cukrów (H2O2 czy kwas glukonowy) zapobiegają psuciu się miodu przez drobnoustroje [Lewkowski i wsp., 2019].
Dodatkowo niektóre białka mogą stymulować funkcjonalnie układu odpornościowego człowieka poprzez uwalnianie cytokiny – czynnika martwicy nowotworu z komórek układu odpornościowego (α–TNF) – która jest zaangażowana w działanie przeciwwirusowe, przeciwbakteryjne i przeciwpasożytnicze mechanizmy obronne gospodarza [Ahmed i wsp., 2018; Bilkova i wsp., 2015]. Bilikova i wsp. [2015] wykazali najsilniejsze właściwości stymulujące miodu akacjowego i lipowego.
Białko MRJP1 pierwotnie wyizolowano z mleczka pszczelego i wykazuje szerokie spektrum działania przeciwko bakteriom Gram-dodatnim i Gram-ujemnym oraz grzybom Candida albicans. Badania wskazują, że cała rodzina białek MRJP stanowi ponad 90% wszystkich białek miodu i jest nieodłącznym elementem działania bakteriobójczego miodu [Brudzynski i Sjaarda, 2015; Brudzynski i wsp., 2015].
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Co interesujące, w związek MGO obecny w miodzie Manuka modyfikuje defensynę-1 oraz MRJP1, wpływając negatywnie na ich aktywność przeciwbakteryjną [Majtan i Majtan, 2010].
Dr Agata Nicewicz
mgr Łukasz Nicewicz
Wydział Nauk Przyrodniczych
Uniwersytet Śląski w Katowicach
Literatura:
Ahmed S, Sulaiman AS, Baig AA, Ibrahim M, Liagat S, Fatima S, Jabeen S, Shamim N, Othman NH, 2018. Honey as a Potential Natural Antioxidant Medicine: An Insight into Its Molecular Mechanisms of Action. Oxidative Medicine and Cellular Longevity. 18:8367846.
Alonso-Torre SR, Cavia MM, Fernández-Muiño MA, Moreno G, Huidobro JF, Sancho MT, 2006. Evolution of acid phosphatase activity of honeys from different climates. Food Chemistry. 97(4):750-755.
Anklam E, 1998. A review of the analytical methods to determine the geographical and botanical origin of honey. Food Chemistry. 63(4):549-562.
Babacan S, Rand AG, 2006. Purification of Amylase from Honey. Journal of Food Science. 70(6):c413-c418.
Baroni MV,Chiabrando GA, Costa C, Wunderlin DA, 2002. Assessment of the floral origin of honey bySDS-page immunoblot techniques. J. Agric. Food Chem. 50:1362-1367.
Berlitz HD, Grosch W, Schieberle P, 2009. Food chemistry, 4th edn. Springer, Leipzig.
Bilkova K, Krakova TK, Yamaguchi K, Yanaguchi Y, 2015. Major royal jelly proteins as markers of authenticity andquality of honey. ArhHigRadaToksikol. 66:259-267.
Borawska M, Arciuch L, Puscion-Jakubiak A, Lewoc D, 2015. Zawartość cukrów (fruktozy, glukozy, sacharozy) i prolinyw różnych odmianach naturalnych miodów pszczelich. ProblHigEpidemiol. 96(4): 816-820.
Brudzynski K, Sjaarda C, 2015. HoneyGlycoproteins Containing Antimicrobial Peptides,Jelleins of the Major Royal Jelly Protein 1, AreResponsible for the Cell Wall Lytic and BactericidalActivities of Honey. PLoS ONE. 10(4):e0120238.
Brudzynski K, Abubaker K, St-Martin L, Castle A, 2011. Re-examining the role of hydrogen peroxide in bacteriostatic and bactericidal activities of honey. Frontiers in Microbiology. 2:213.
Brudzynski K, Sjaarda C, Lannigan R, 2015.MRJP1-containing glycoproteins isolated from honey, a novel antibacterial drug candidate with broad spectrum activity against multi-drug resistant clinical isolates. Frontiers in Microbiology, 6.
BrudzynskiK,Lannigan R, 2012. Mechanism of honey bacteriostatic action against MRSA and VRE involveshydroxyl radicals generated from honey’s hydrogen peroxide. Front. Microbiol. 3:1-8.
Brudzynski K,Sjaarda C, Maldonado-Alvarez L, 2013. A new look on protein-polyphenol complexation duringhoney storage: Is this a random or organized event with the help of dirigent-like proteins? PLoS ONE. 8:e72897.
Bucekova M, Jardekova L, Juricova V, Bugarova V, Di Marco G, Gismondi A, AMajtan J, 2019.Antibacterial Activity of Different Blossom Honeys: New Findings. Molecules. 24(8):1573.
Bucekova M, Sojka M,ValachovaI,Martinotti S, Ranzato E,Szep Z, Majtan V, Klaudiny J, Majtan J, 2017.Bee-derived antibacterial peptide, defensin-1, promotes wound re-epithelialisation in vitro and in vivo. Sci.Rep. 7:7340.
Chua LS, Lee JY, Chang GF, 2013. Honey protein extraction and determination by mass spectrometry. Anal Bioanal Chem. 405:3063-3074.
Chua LS, Lee YJ, Chan GF, 2013. Honey protein extraction and determination by mass spectrometry. Analytical and Bioanalytical Chemistry. 405(10):3063-3074.
Codex alimentarius, 1994. Codex Standardfor Honey, Codex Stan 121981, Rev.1(11). FAO; Rome, Italy.
Davies AMC, 1976. The application of amino acid analysis to the determination of the geographical origin of honey. Journal of Food Technology. 11:515-523.
Di Girolamo F, D'Amato A, Righetti PG, 2012. Assessment of the floral origin of honey via proteomic tool. Journal of Proteomics. 75:3699-3693.
Dimins F, Mikelsoe V, Kuka P, Jefremoves AN, 2014. Effect of different types of heat treatment on invertase activity in honey. Foodbalt Proceedings. 2014: 284-289.
Dubiago G, Nowak A, Klimowicz A, 2018. Selected properties of honey especially useful in cosmetology. PostępyFitoterapii. 1/2018: 58-64.
Dustman JH, 1967.Messung von Wasserstoffperoxid und Enzymaktivität in mitteleneuropäischenHonigen. Z Bienenforsch. 9:66-73.
Dustman JH, 1971. UÈ ber die KatalaseaktivitaÈ t in Bienenhonigaus der Tracht der HeidekrautgewaÈchse (Ericaceae). ZeitschriftfuÈrLebensmittel-Untersuchung und Forschung. 145:292-295.
Dyrektywa Rady Europy 2001/110/WEz dnia 20 grudnia 2001 r.odnosząca się do miodu. OfficialJournal L 010, 12/01/2002 P. 0047- 0052.
Erban T,Shcherbachenko E, Talacko P, Harant K, 2019. The unique protein composition of honey revealedby comprehensive proteomic analysis: Allergens, venom-like proteins, antibacterial properties, royal jellyproteins, serine proteases, and their inhibitors. J. Nat. Prod. 82(5):1217-1226.
Fagain CO,1997. Protein Stability and Stabilization of Protein Function. Georgetown, TX: Landes Bioscience.
Godlewska M, Świsłocka R, 2015. Fizykochemiczne i przeciwdrobnoustrojowe właściwości miodów z rejonu Podlasia. Kosmos. 2(307):347-352.
Gonnet M., 1988. Naturalnyjeantibioticzeskije faktory, sodierżaszcziesja w miedie. [In:] Produkty pczełowodstwa – piszcza, zdorowie, krasota. Izd. Apimondii, Bucharest 33-7.
Grecka K, Kus PM, Worobo RW, Szweda P, 2018.Study of the anti-staphylococcal potential of honeys producedin Northern Poland. Molecules. 23:260.
Hadorn H, Zürcher K, 1966.EineverbessertepolarimetrischeMethodezurSaccharasezahlbestimmungimHonig. Dt. Lebensm. Rdsch. 62:195-201.
Hermosı́n I, Chicón RM, Cabezudo DM., 2003. Free amino acid composition and botanical origin of honey. Food MP,Muniategui S, Sancho MT, 2005. Precise method for the measurement of catalase activity in honey. J. AOAC Int. 88: 800-804.
Irish J, Blair S, Carter DA, 2011. The Antibacterial Activity of Honey Derived from Australian Flora. PLOS ONe. 6(3):e18229.
Janiszewska K, Aniołowska M, Howis M, Nowakowski P, 2011. Kompozycja wolnych aminokwasówjako marker źródła pochodzenia miodów. Przemysł Chemiczny. 90(5): 806-808.
Kędzia B, Hołderna-Kędzia E, 2017. Współczesne poglądy na mechanizm przeciwdrobnoustrojowego działania miodu. Post Fitoter. 18(4): 290-297.
Kowalski S, Lukasiewicz M, Bednarz S, Panuś M, 2012.Diastase number changes during thermal and microwave processing of honey. Czech J. Food Sci. 30(1):21-26.
Krauze A, KrauzeJ, 1991.Changes in chemical composition of stored honeydew honeys. Acta Aliment. Pol. 2(119):126 –140.
Kretavicius J, Kurtinaitiene B, Racys J, Čeksteryte V, 2010. Inactivation of glucose oxidase during heat-treatment de-crystallization of honey. Zemdirbyste. 97(4):115-122.
Kwakman PH, TeVelde AA, De Boer L, Vandenbroucke-Grauls CM, Zaat SA, 2011. Two major medicinal honeys have different mechanisms of bactericidal activity. PLoS One. 6:e17709.
Kwakman PHS, Boer L, Ruyter-Spira CP,Creemers-Molenaar T, Helsper JPFG, Vandenbroucke-Grauls CMJE, Zaat SAJ, Velde AA, 2011. Medicalgradehoney enriched with antimicrobial peptides has enhancedactivity against antibiotic-resistant pathogens. Eur JClinMicrobiol Infect Dis. 30:251-7.
Lee DC, Lee SY, Cha SH, Choi YS, Rhee HI, 1998. Discrimination of native bee-honey and foreign bee-honey by SDS-PAGE. Korean J Food Sci. 30:1-5.
Lewkowski O, Muresan CI, Dobrizsch D, Fuszard M, Erler S, 2019. The Effect of Diet on the Composition and Stability of Proteins Secreted by Honey Bees in Honey. Insects. 10: 282.
Majewska E, Drużyńska B, Derewiaka D, Cicierska M, Wołosiak R, 2015. Fizykochemiczne wyróżniki jakości wybranych miodów nektarowych. Bromat. Chem. Toksykol. XLVIII, 3: 440-444.
Majtan J, Bohova J, Prochazka E, Kaludiny J, 2014. Methylglyoxal may affect hydrogen peroxide accumulation in manuka honeythrough the inhibition of glucose oxidase. J Med Food. 17(2):290-292.
Majtan J, Majtan V, 2010. Is manuka honey the best type of honey for wound care? J Hosp Infect. 73:305–-306.
Oddo LP, Piazza MG, Pulcini P, 1999. Invertase activity in honey. Apidologie. 30:57-65.
PN-88/A-77626. Polska Norma – Miód pszczeli, 1988. Polski Komitet Normalizacji, Miar i Jakości. Warszawa: WydawnictwaNormalizacyjne Alfa.
Pontoh J, Low NH, 2002. Purification and characterization of beta--glucosidase from honey bees (Apis mellifera). Insect Biochem. Mol. Biol. 32:679-690.
Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 14 stycznia 2009 r. w sprawie metod analiz związanych z dokonywaniem oceny miodu. Dz.U. 2009 nr 17 poz. 94.
Rybak-Chmielewska H, Szczęsna T, 2008. Produkty pszczele. [W:] Wilde J., Prabucki J. (red.), Hodowla pszczół. PWRi, Poznanń, str 323-349.
Samarghandian S, Farkhondeh T, Samini F, 2017. Honey and health: A review of recent clinical research. Pharmacognosy Research. 9(2):121-127.
Sánchez MP,Huidobro JF,Mato I,Muniategui S, Sancho MT, 2001. Evolution of Invertase Activity in Honey over Two Years. Journal of Agricultural and Food Chemistry. 49(1): 416-422.
Stagos D,Soulitsiotis N,Tsadila C,Papaeconomou S,Arvanitis C,Ntontos A, Karkanta F, Adamou-Androulaki S,Petrotos K,Spandidos DA, 2018. Antibacterial and antioxidant activity of different types of honey derived from Mount Olympus in Greece. Int. J. Mol. Med. 42:726-734.
Vallianou N, 2014. Honey and its Anti-Inflammatory, Anti-Bacterial and Anti-Oxidant Properties. General Medicine. 2:2.
Von der Ohe W, Dustmann JH, Von der Ohe K, 1991. ProlinalsKriterium der Reife des Honigs. Deutsche Lebensmittel-Rundschau. 87(12):383-386.
Wesołowska M, Dżugan M, 2017. Aktywność i stabilność termiczna diastazy występujęcej w podkarpackich miodach odmianowych. Żywność. Nauka. Technologia. Jakość. 24(4): 103-112.
WestonRJ, 2000. The contribution of catalase and other natural products to the antibacterial activity of honey: a review. Food Chem. 71:235-239.
White JW, 1957. The composition of honey. Bee World. 38:57-66.
White JW, 1966.Inhibine and glucose oxidase in honey – a review.Am Bee J. 106:214-6.
White JW, 1978. Honey. Adv. Food Res. 24:287-374.
Won SR, Lee DC, Ko SH, Kim JW, Rhee HI,2008. Honey major protein characterization and its application to adulteration detection. Food Res Int, 41:952-956.
Żegliński J, 2006. Stabilizacja nadtlenku wodoru w kserożelukrzemiankowym – badanie oddziaływań składników kompozytu i jego charakterystyka. Praca doktorska. Zakład Chemii Nieorganicznej AM w Gdańsku. Str.: 63.
Zhang YZ, Chen YF, Wu YQ, Si JJ, Zhang CP, Zheng HQ, Hu FL, 2019. Discrimination ofthe entomological origin of honey according to the secretions of the bee (Apiscerana or Apis mellifera).Food Res. Int. 116:362-369.



