Agata Nicewicz, Łukasz Nicewicz
Właściwości antyoksydacyjne miodu
Miód stanowi bogatą mieszaninę związków chemicznych o odmiennej naturze. Jego skład może się różnić w zależności od regionu, gdzie jest wytwarzany, jego pochodzenia botanicznego, gleby, na której rosną rośliny, strefy klimatycznej, nasłonecznienia, wilgotności czy procesu jego pozyskiwania i magazynowania.

Fot. Ruslana71, Pixabay
Zazwyczaj charakteryzuje się obecnością co najmniej 181 substancji. Skład miodu będzie wpływał na jego właściwości odżywcze oraz zdrowotne, a tym samym odmiany miodu będą wykazywać zróżnicowane właściwości prozdrowotne (Alvarez-Suarez i wsp., 2010; Khalil i wsp., 2010; Miguel i wsp., 2017; Dubiago i wsp., 2018).
Głównym komponentem miodu są węglowodany (cukry), stanowiące do 80% suchej masy, a także woda, która w zależności od gatunku miodu może stanowić do 20% jego masy. Pozostałe składniki stanowią ok. 3% suchej masy i są najcenniejszymi elementami miodu, decydując o jego właściwościach przeciwdrobnoustrojowych, przeciwwirusowych, przeciwzapalnych, antyseptycznych oraz leczniczych [Alvarez-Suarez i wsp., 2010; Basista, 2013; Dubiago i wsp., 2018].
Należą do nich, występujące w niewielkiej ilości witaminy (C, z grupy B: B1, B2, B3, B5, B6, B7, B9), enzymy pochodzące z roślin i układu pokarmowego pszczoły (oksydaza glukozy, katalaza, fosfataza kwaśna), kwasy organiczne (m.in. kwas: octowy, jabłkowy, masłowy, cytrynowy, bursztynowy, glukonowy), aminokwasy (w miodzie można wyróżnić ok. 26 aminokwasów, z czego najważniejsza jest grupa 20 aminokwasów, na której czele znajduje się prolina), mikroelementy (m.in. żelazo, cynk, wapń, potas, fosfor, magnez, selen, chrom i mangan).
Cennymi składnikami są również polifenole. Do tej grupy związków zaliczamy kwasy fenolowe, dominujące nad drugą grupą; m.in. kwas wanilinowy, kwas kawowy, kwas galusowy oraz flawonoidy, m.in. kemferol, kwercetyna, chryzyna [Dmowski i Wilczyńska, 2015; Ahmed i wsp., 2018].
Wolne rodniki i stres antyoksydacyjny
Wyjaśnienie mechanizmu działania wolnych rodników i powstawania stresu oksydacyjnego wymaga przypomnienia budowy atomów. Zgodnie z teorią atomistyczną Johna Daltona cała materia zbudowana jest z atomów. Oznacza to, że zarówno krzesło, na którym siedzimy, jak i jabłko, które jemy, także zbudowane są z atomów. Każdy atom zbudowany jest z jądra, znajdującego się w jego centrum.
Jądro zbudowane jest z protonów o dodatnim ładunku elektrycznym i neutronów pozbawionych ładunku. Wokół jądra po orbitach krążą cząstki zwane elektronami o ujemnym ładunku elektrycznym, tworząc tzw. chmurę elektronową (Fig. 1A). Elektrony na orbitach są sparowane – posiadają elektrony „do pary”. Atomy tworzą pierwiastki chemiczne, a te związki chemiczne, budujące np. organizm. Można więc powiedzieć, że np. atomy węgla, tlenu, azotu, siarki, wapnia czy fosforu tworzą związki chemiczne (białka, cukry, tłuszcze), które budują nasz organizm (Fig. 1B).
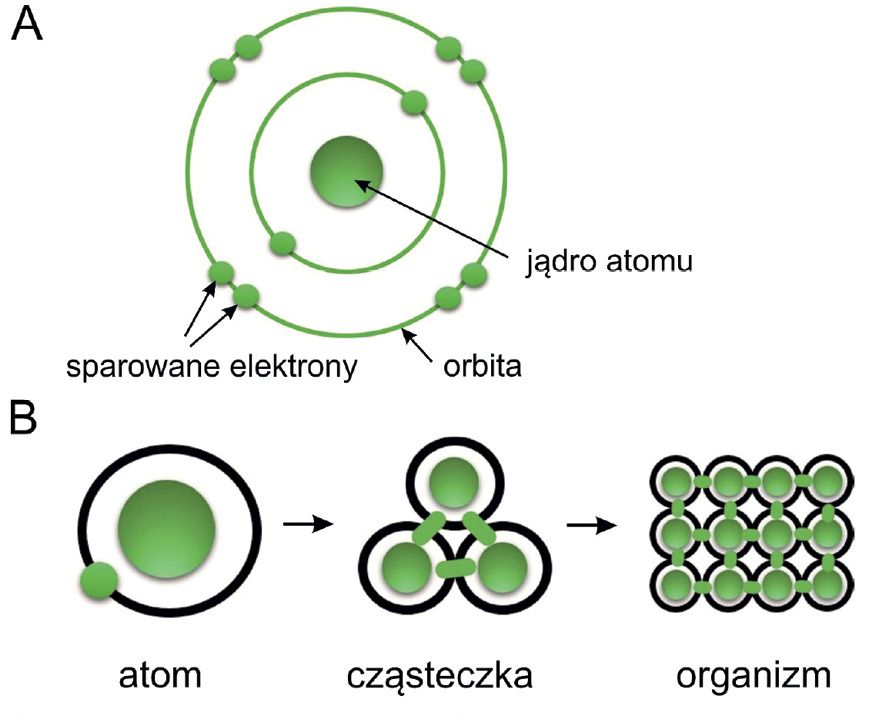
Fig. 1. Budowa atomu (A) oraz atomistyczna budowa materii (B).
Wolne rodniki to atomy, cząsteczki lub jony charakteryzujące się specyficzną budową i zdolnością do samodzielnej egzystencji. Cechują się one obecnością jednego lub więcej niesparowanych elektronów (Fig. 2A). Taki „wybrakowany atom” dąży do uzupełnienia brakującego elektronu poprzez zabranie go innej cząsteczce (Fig. 2B). Kiedy osiągnie swój cel – staje się stabilny („pełny”), ale jednocześnie powoduje powstanie innego wolnego rodnika (Fig. 2C). Nowy wolny rodnik również poszukuje „dawcy” elektronów. W ten sposób rozpoczyna się łańcuchowa reakcja powstawania kolejnych „wybrakowanych” atomów (Karbarz, 2010; Bombolewska i wsp., 2013).
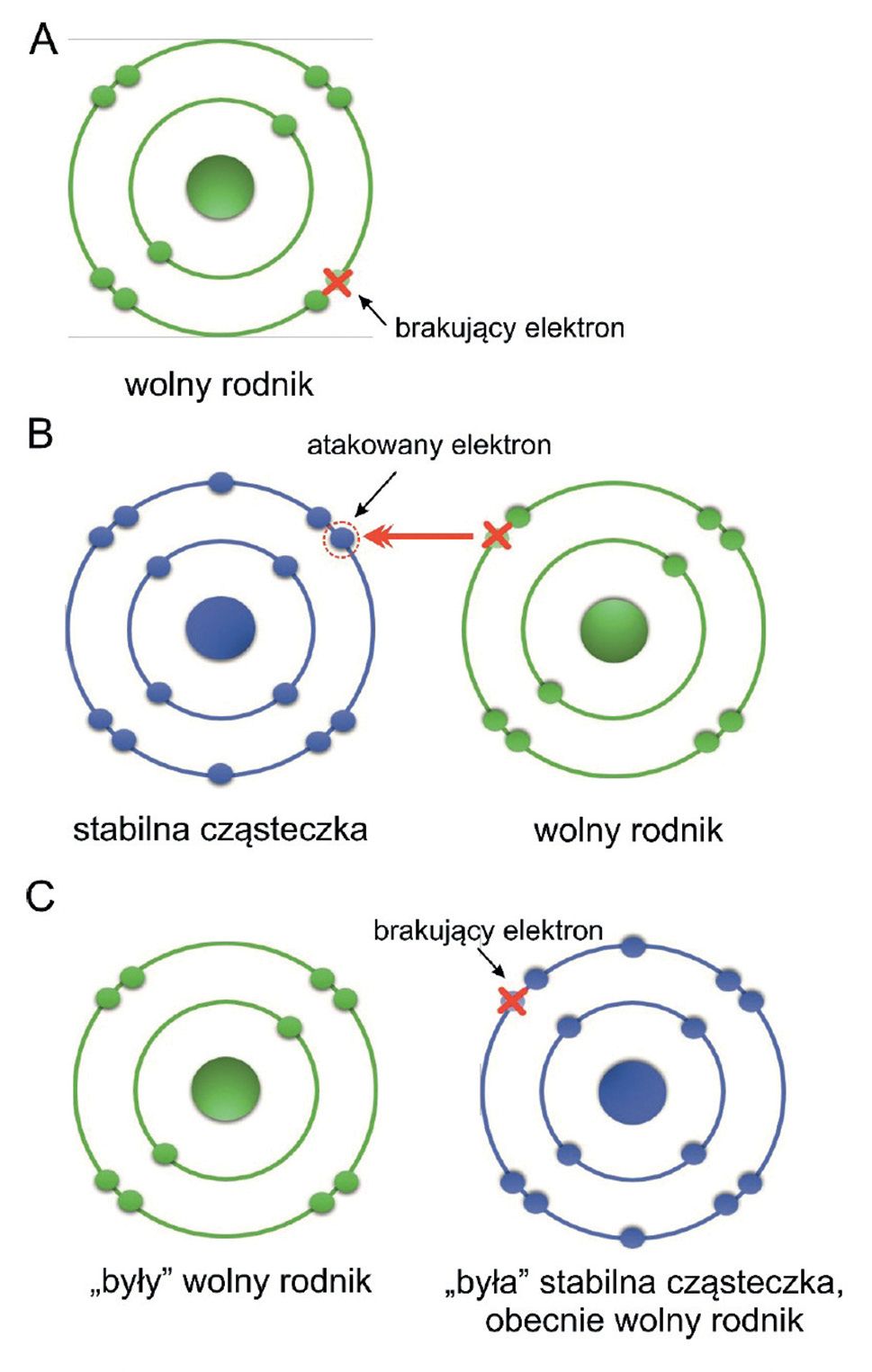
Fig. 2. Schemat budowy wolnego rodnika (A) oraz mechanizm działania wolnych rodników: wolny rodnik atakuje stabilne cząsteczki w celu uzupełnienia brakującego elektronu (B), co w ostateczności prowadzi do powstania nowego wolnego rodnika, którym jest „była” stabilna cząsteczka – dawca elektronu dla wolnego rodnika (C). Tak powstały wolny rodnik poszukuje kolejnej stabilnej cząsteczki – dawcy elektronu (nie pokazane). Na podstawie: Karbarz, 2010; Bombolewska i wsp., 2013.
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Niewielkie stężenia wolnych rodników odgrywają istotną rolę dla funkcjonowania organizmu. Biorą one udział m.in. w reakcjach obronnych przed patogenami, w skurczach mięśni, w przenoszeniu sygnałów międzykomórkowych (w tym między neuronami), ekspresji genów czy regulują podziały i różnicowanie komórek organizmu [Lobo i wsp., 2010; Gutowicz, 2011].
Należy jednak pamiętać, że jeśli w krótkim czasie dojdzie do powstania dużej ilości wolnych rodników (np. pod wpływem czynników chorobotwórczych), a w organizmie nie mamy wystarczającej ilości antyoksydantów, to wtedy dochodzi do tzw. stresu oksydacyjnego. Prowadzi to bezpośrednio do uszkodzenia komórek i ich materiału genetycznego (mutacji, które mogą być początkiem nowotworzenia), a w ostateczności do ich śmierci [Kulbacka i wsp., 2009; Gutowicz, 2011].
Właściwości antyoksydacyjne miodu
Jedną z najcenniejszych właściwości miodu są właściwości antyoksydacyjne, za które odpowiadają: karotenoidy, kwasy organiczne (np. kwas cytrynowy), aminokwasy (np. prolina), enzymy (katalaza, glukooksydaza), witaminy C i E, a także polifenole (kwasy fenolowe – dominujące nad drugą grupą; m.in. kwas wanilinowy, kwas kawowy, kwas galusowy i flawonoidy – m.in. kemferol, kwercetyna, chryzyna). Jak wskazują badania, to polifenole pełnią najistotniejszą funkcję w kształtowaniu ochrony przed stresem oksydacyjnym [Aljadi i Kamaruddin, 2004; Majewska i Trzanek, 2009; Ahmed i wsp., 2018].
Zawartość związków fenolowych w miodzie waha się od 0,01 do kilkudziesięciu mg/kg miodu (Dmowski i Wilczyńska, 2015). Co interesujące, ciemny miód manuka, pochodzący z krzewu Leptospermum scoparium, wykazuje najwyższą wartość pod względem zawartości fenoli i zdolności przeciwutleniającej w porównaniu do innych miodów. Dlatego też bardzo często stosowany jest jako „złoty standard”1 przy analizie właściwości antyoksydacyjnych innych miodów gatunkowych (Alvarez-Suarez i wsp., 2014).
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Do czynników biotycznych, istotnych dla kształtowania składu ilościowego i jakościowego polifenoli w roślinach, zaliczamy: gatunek rośliy, jej odmiany botaniczne i agronomiczne, jej wiek oraz fazę wzrostu (Biesiada i Tomczak, 2012). Miody ciemniejsze (np. gryczany, wrzosowy i spadziowy) zawierają więcej polifenoli i cechują się silniejszymi właściwościami antyoksydacyjnymi w porównaniu do miodów jasnych (np. lipowego). Podobnie, miody z wyższą zawartością wody (np. akacjowy) będą charakteryzować się silniejszymi właściwościami antyoksydacyjnymi.
Ponadto miody spadziowe cechują się wyższą zawartością polifenoli niż miody nektarowe [Frankel i wsp., 1998; Wilczyńska, 2010; Dubiago i wsp., 2018]. Wśród polskich miodów odmianowych miód gryczany i wrzosowy znajdują się w czołówce miodów o najsilniejszych właściwościach antyoksydacyjnych [Wilczyńska, 2010].
Ciekawostką jest, że właściwości miodu do zapobiegania powstawania wolnych rodników i ich wymiatania można zwiększyć. Wzbogacanie miodu wielokwiatowego propolisem powoduje wzrost zawartości związków fenolowych, a tym samym – zwiększa to właściwości antyoksydacyjne miodów ponad trzykrotnie [Socha i wsp., 2016].
Przeciwutleniacze zawarte w miodzie (głównie polifenole) odgrywają istotną rolę w ochronie organizmu człowieka przed różnymi schorzeniami. Udowodniono bezpośredni wpływ spożywania miodu na wzrost właściwości antyoksydacyjnych osocza (frakcja krwi) zdrowego człowieka [Schramm i wsp., 2003].
Codzienne spożywanie miodu przez okres 2 tygodni w dawkach 1,2 g miodu na każdy kg ciała powodowało wzrost stężenia witaminy C we krwi o 47%, β-karoten o 3% oraz innych przeciwutleniaczy o 19%, w porównaniu do grupy, która nie spożywała miodu [Al-Waili, 2003]. W innym badaniu wykazano, że związki fenolowe z miodu są biodostępne i że zwiększają aktywność przeciwutleniającą osocza człowieka [Schramm i wsp., 2003].
Niektóre polifenole zawarte w miodzie testowane są pod kątem obiecujących środków farmakologicznych w leczeniu raka. Kwas kawowy, galangina, kemferol i kwercetyna wykazują silne właściwości antyoksydacyjne oraz antyangiogenne, czyli hamujące tworzenie się naczyń krwionośnych w powstających guzach nowotworowych (Ahn i wsp., 2009). Ponadto ester fenylowy kwasu kawowego ma właściwości przeciwzapalne i immunomodulujące, a u szczurów hamuje rozwój guza jelita grubego.
Chryzyna hamuje namnażanie komórek glejaka oraz indukuje śmierć tych komórek. Również kwercetyna hamuje namnażanie komórek glejaka, ale również raka piersi oraz zmniejsza ich przeżycie. Inny flawonoid – apigenina – hamuje proliferację (mnożenie się) komórek raka jelita grubego, piersi, szyjki macicy czy wątroby [Khalil i wsp. 2010].
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Zdolność związków antyoksydacyjnych zawartych w miodach do modulowania produkcji i usuwania wolnych rodników może przyczynić się również do pomocy w rozwiązaniu stanu zapalnego typowego dla ran przewlekłych [Jackson i wsp., 2008].
Badania na szczurach wskazują na możliwość wpływu składników miodu na funkcjonowanie układu rozrodczego. Narażenie na dym papierosowy może wywoływać stres oksydacyjny i uszkodzenie jąder. Kilkutygodniowa suplementacja miodu poprawia funkcjonalnie jąder szczurów poprzez zwiększenie liczby komórek produkujących testosteron, zwiększenie produkcji plemników, pozytywnie wpływa na ruchliwość i morfologię plemników [Erejuwa i wsp., 2012].
Jak wykazano powyżej, miód to ogromne źródło związków o działaniu antyoksydacyjnym, które determinują jego właściwości prozdrowotne. Spożywanie miodu przyczynia się do poprawy odporności organizmu, przeciwdziała powstawaniu wielu chorób, a także może być pomocne w ich leczeniu.
dr Agata Nicewicz
mgr Łukasz Nicewicz
Wydział Nauk Przyrodniczych
Uniwersytet Śląski w Katowicach
1 - Złoty stanard - to pojęcie zewnętrznego kryterium, który stanowi punkt odniesienia dla analizowanych wyników.
Literatura
Ahmed S., Sulaiman A. S., Baig A.A., Ibrahim M., Liagat S., Fatima S., Jabeen S., Shamim N., Othman N. H., 2018. Honey as a Potential Natural Antioxidant Medicine: An Insight into Its Molecular Mechanisms of Action. Oxid Med Cell Longev. 18: 8367846.
Ahn M.R., Kunimasa K., Kumazawa S., et al., 2009. Correlation between antiangiogenic activity and antioxidant activity of various components from propolis. Mol Nutr Food Res. 53(5): 643–51.
Aljadi A.M., Kamaruddin M.Y., 2004. Evaluation of the phenolic contents and antioxidant capacities of two Malaysian floral honeys. Food Chem. 85: 513–518.
Alvarez-Suarez J.M., Gasparrini M., Forbes-Hernández T.Y., Mazzoni L., Giampieri F., 2014. The Composition and Biological Activity of Honey: A Focus on Manuka Honey. Foods. 3(3): 420–432.
Alvarez-Suarez J.M., Tulipani S., Diaz D., Estevez Y., Romandini S., Giampieri F., Diamani E., Astolfi P., Bompadre S., Battino M., 2010. Antioxidant and antimicrobial capacity of several monofloral Cuban honeys and their correlation with color, polyphenol content and other chemical compounds. Food Chem Toxicol. 48(8-9): 2490e2499.
Al-Waili N.S., 2003. Effects of daily consumption of honey solution onhematological indices and blood levels of minerals and enzymes in normal individuals. J Med Food. 6: 135–140.
Anand S., Pang E., Livanos G., Mantri N., 2018. Characterization of Physico-Chemical Properties and Antioxidant Capacities of Bioactive Honey Produced from Australian Grown Agastache rugosa and its Correlation with Colour and Poly-Phenol Content. Molecules. 23: 108.
Basista K., 2013. Właściwości biologiczne i prozdrowotne miodu oraz jego zastosowanie jako zdrowa żywność. Gazeta Farmaceutyczna. 22(3): 26–28.
Biesiada A., Tomczak A., 2012. Biotic and abiotic factors affecting the content of the chosen antioxidant compounds in vegetables. Wrocław University of Environmental and Life Sciences. 74: 55–78.
Bombolewska K., Dróżdż J., Koim-Puchowska B., 2013. Influence of environmental pollution on human health condition technology. Archiwum Gospodarki Odpadami i Ochrony Środowiska. 15(1): 63–68.
Dmowski P., Wilczyńska A., 2015. Wpływ dodatku miodu na antyoksydacyjne właściwości naparów herbaty czarnej. Probl Hig Epidemiol. 96(3): 688–692.
Dubiago G., Nowak A., Klimowicz A., 2018. Wybrane właściwości miodu szczególnie przydatne w kosmetologii. Post Fitoter. 19(1): 58–64.
Erejuwa O.O., Sulaiman S.A., Ab Wahab M.S., 2012. Honey: A Novel Antioxidant. Molecules. 17(4) :4400–23.
Frankel S., Robinson G.E., Berenbaum M R., 1998. Antioxidant capacity and correlated characteristics of 14 unifloral honeys. Journal of Apicultural Research. 37(1), 27–31.
Gutowicz M., 2011. Wpływ reaktywnych form tlenu na ośrodkowy układ nerwowy. Postepy Hig Med. Dosw. 65: 104–113.
Hamouz K., Lachman J., Dvořăk P., Piviec V., 2005. The effect of eco-logical growing on potatoes yield and quality. Plant Soil Environ. 51(9): 397–402.
Heimler D., Romani A., Ieri F., 2017. Plant polyphenol content, soil fertilization and agricultural management: a review. European Food Research and Technology. 243(7): 1107–1115.
Jackson A.S., Cooper R., Burton N., 2006. Free radical production and quenching in honeys with wound healing potential. J Antimicrob Chemother. 58(4): 773–7.
Jarosz Z., 2006. Effect of differents types of potassium fertilisation on the chemical composition of leaves and fruits of greenhouse tomatoes grown in various substrates. Acta Sci. Pol. Hortorum Cultus. 5(1): 11–18.
Karbarz M., 2010. Źródła powstawania i oddziaływanie środowiskowe wolnych rodników. Zeszyty Naukowe SGSP / Szkoła Główna Służby Pożarniczej. 40: 59–67.
Khalil M.I., Sulaiman S.A., Boukraa L., 2010. Antioxidant Properties of Honey and Its Role in Preventing Health Disorder. The Open Nutraceuticals Journal. 3, 6–16.
Kulbacka J., Saczko J., Chwiłkowska A., 2009. Stres oksydacyjny w procesach uszkodzenia komórek. Pol. Merk. Lek. XXVII.157: 44.
Lobo V., Patil A., Phatek A., Chandra N., 2010. Free radicals, antioxidants and functional foods: Impact on human health. Pharmacogn Rev. 4(8): 118–126.
Miguel M.G., Antunes M.D., Faleiro M.L., 2017. Honey as a Complementary Medicine. Integr Med Insights. 12: 1178633717702869.
Muñoz O., Copaja S., Speisky H., Pen A.R.C., Montenegro G., 2007. Content of flavonoids and phenolic compounds in Chilean honeys and ORAC index. Quımica Nova. 30, 848–851.
Rimmer D.L., 2006. Free radicals, antiox-idants, and soil organic matter recal-citrance. European Journal of Soil Science. 57: 91–94.
Schramm D., Karim M., Schrader H.R., Holt R.R., Cardetti M., Keen C.L., 2003. Honey with High Levels of Antioxidants Can Provide Protection to Healthy Human Subjects. J Agric Food Chem. 51: 1732–5.
Socha R., Habryka C., Juszczak L., 2016. Wpływ dodatku propolisu na zawartość wybranych związków polifenolowych oraz aktywność przeciwutleniającą miodu. Żywność. Nauka. Technologia. Jakość. 5(108): 127–139.
Wilczyńska A, 2010. Phenolic content and antioxidanty activity of different types of Polish honey A short report. Pol. J. Food Nutr. Sci. 60(4), 309–313.
Yochum L., Kushi L.H., Meyer K., Folsom A.R., 1999. Dietary flavonoid intake and risk of cardiovascular disease in postmenopausal women. Am J Epidemiol. 149: 943–-9.



