Z artykułu dowiesz się m.in.:
- jak wypadają polskie miody odmianowe w porównaniu do miodu manuka;
- która z przebadanych patok wypadła najgorzej pod względem HMF;
- czy ciemniejsze miody rzeczywiście wykazują większą bioaktywność.
Polskie miody odmianowe a miód manuka: porównanie wartości żywieniowej
Miód jest naturalnym produktem żywnościowym, który ma długą historię w medycynie naturalnej. Łatwo zauważalne różnice w smaku, barwie, zapachu i konsystencji poszczególnych odmian miodów wynikają z różnorodności roślin miododajnych lub środowiska życia owadów, z których pszczoły pobierają wydzieliny. Na smak i wartość żywieniową miodu mają wpływ także położenie geograficzne terenów występowania roślin pożytkowychi lokalne warunki klimatyczne (m.in. temperatura, gleba, opady) oraz warunki przetwarzania i przechowywania miodu przez człowieka [Janini i in., 2014].

Miodom przypisuje się wysoką wartość żywieniową, która wynika z kompozycji składników wykazujących właściwości antyoksydacyjne, antybiotyczne, przeciwzapalne, przeciwcukrzycowe lub przeciwnowotworowe [Ajibola i in., 2012], a stopień bioaktywności miodu zróżnicowany jest odmianowo [Gkoutzouvelidou i in., 2021]. W składzie miodu znajdują się głównie cukry proste (fruktoza i glukoza) oraz woda, ale działanie biotyczne powiązane zostało przede wszystkim z takimi związkami jak: metyloglioksal (MGO), nadtlenek wodoru (H2O2), związki fenolowe (flawonoidy) oraz niektóre peptydy, między innymi enzym defensyna pszczela [Nolan i in., 2019]. Wielokrotnie analizowano terapeutyczne działanie miodów z różnych regionów świata [Gomes i in., 2010], a pochodzące z Nowej Zelandii i części Australii miody manuka zostały w wielu krajach oficjalnie dopuszczone jako miejscowy preparat medyczny wspomagający leczenie ran [Johnston i in., 2018; Carter i in., 2016]. Rosnące zainteresowanie miodem jako nutraceutykiem1 wynika nie tylko z aktualnych trendów żywieniowych, promujących produkty naturalne o wysokiej bioaktywności, ale również ze zwiększającej się liczby bakterii opornych na antybiotyki [Maddocks i Jenkins, 2013; Combarros-Fuertes i in., 2020].
Cel naszych badań
Celem przeprowadzonych badań była ocena wartości żywieniowej nowozelandzkich miodów manuka oraz miodów odmianowych pochodzących z różnych rejonów Polski, na podstawie wybranych parametrów fizykochemicznych.
Metodyka
Przedmiotem badań były miody odmianowe o uznanych powszechnie właściwościach prozdrowotnych: miód manuka oraz gryczany, lipowy, nawłociowy i nektarowo-spadziowy, zakupione w handlu detalicznym. Wybrane zostały miody pochodzące z regionów Polski o niewielkim zanieczyszczeniu środowiska i oddalonych od ośrodków przemysłowych: Pojezierza Drawskiego (opisywane w dalszej części cyfrą 1), Beskidu Żywieckiego (opisywane w dalszej części cyfrą 2), Beskidu Sądeckiego (opisywane w dalszej części cyfrą 3), a także importowane miody manuka MGO 400+ z Nowej Zelandii, pochodzące od trzech producentów (oznaczone dalej odpowiednio cyframi 4, 5 i 6).
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Wyniki
Metyloglioksal (MGO) jest związkiem organicznym o wzorze C3H4O2 należącym do grupy aldehydów, występującym naturalnie w wielu produktach spożywczych, między innymi w serach, pieczywie, kawie, miodzie i niektórych alkoholach [Belitz i in., 2009]. Wykazuje silne właściwości przeciwutleniające i jest uznanym nutraceutykiem – hamuje namnażanie bakterii, drożdży, pleśni i wirusów [Mavric i in., 2008]. Stwierdzono, że przyspiesza gojenie ran, oparzeń i odmrożeń, a także zabezpiecza je przez zakażeniem [Martinotti i Ranzato, 2018]. Metyloglioksal wzmacnia również układ odpornościowy i wpływa korzystnie na pracę układu pokarmowego [Martinotti i Ranzato, 2014]. Związek ten występuje praktycznie we wszystkich rodzajach miodów [Da Silva i in., 2018], ale jego stężenie jest zróżnicowane odmianowo i regionalnie (Ilustr. 1). W analizowanych polskich miodach oznaczono o wiele niższy poziom MGO (5,2–20,5 mg·kg-1) niż w nowozelandzkich miodach manuka, produkowanych z nektaru kwiatowego krzewów manuka i występujących jedynie w tej części świata (513,9–532,9 mg·kg-1). W przypadku nowozelandzkich miodów manuka były to wartości zgodne z deklaracjami producentów zamieszczonymi na opakowaniach, według których zawartość MGO powinna przekraczać poziom 400 mg·kg-1. Zauważono, że zawartość metyloglioksalu we wszystkich trzech analizowanych miodach manuka była bardzo wysoka, prawie 25 razy wyższa niż w miodzie gryczanym z terenów Beskidu Żywieckiego (gryczany 2) i aż około 100 razy wyższa niż w miodzie nawłociowym z Pojezierza Drawskiego (nawłociowy 1). Miody pochodzące z terenów Beskidu Żywieckiego charakteryzowały się wyższą zawartością MGO niż pozostałe miody polskie.
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Odpowiednia kwasowość i aktywność wody w miodzie determinują jego stabilność przechowalniczą. Aktywność wody w miodzie powinna być niższa niż 0,62 [Dz.U. Nr 17, poz. 94, pkt. IX wraz z późn. zm. Dz.U. z 2015 r.] i w przypadku wszystkich analizowanych próbek była prawidłowa (Tab. 1). Miody pochodzące z terenów Beskidu Żywieckiego (2) charakteryzowały się nieznacznie wyższą aktywnością wody niż pozostałe (Aw = 0,61 gryczany 2 i nektarowo-spadziowy 2), a najniższą, świadczącą o wyższej trwałości przechowalniczej od pozostałych miodów, miał miód manuka 4. Aktywność wody na poziomie wyższym niż zalecana w normach mogłaby doprowadzić do rozwoju drożdży lub bakterii.
Odmiana miodu |
Aw (-) |
pH (-) |
wolna kwasowość (mval·kg-1) |
gryczany 1 |
0,58 ± 0,08 |
3,87 ± 0,12 |
29,3 ± 2,9 |
gryczany 2 |
0,61 ± 0,02 |
4,26 ± 0,134 |
37,2 ± 2,6 |
gryczany 3 |
0,60 ± 0,03 |
4,02 ± 0,12 |
15,7 ± 1,6 |
lipowy 1 |
0,60 ± 0,01 |
4,35 ± 0,13 |
14,5 ± 2,9 |
lipowy 2 |
0,61 ± 0,07 |
4,09 ± 0,12 |
16,1 ± 1,6 |
lipowy 3 |
0,57 ± 0,04 |
4,34 ± 0,13 |
14,3 ± 2,9 |
nawłociowy 1 |
0,57 ± 0,08 |
3,82 ± 0,11 |
17,2 ± 1,7 |
nawłociowy 2 |
0,56 ± 0,09 |
3,93 ± 0,12 |
21,6 ± 2,2 |
nawłociowy 3 |
0,59 ± 0,06 |
3,93 ± 0,12 |
16,4 ± 1,6 |
nektarowo-spadziowy 1 |
0,57 ± 0,02 |
3,96 ± 0,12 |
21,7 ± 2,2 |
nektarowo-spadziowy 2 |
0,61 ± 0,02 |
4,44 ± 0,13 |
29,0 ± 2,9 |
nektarowo-spadziowy 3 |
0,57 ± 0,04 |
4,17 ± 0,13 |
31,1 ± 2,2 |
manuka 4 |
0,52 ± 0,04 |
4,27 ± 0,13 |
18,7 ± 1,9 |
manuka 5 |
0,58 ± 0,07 |
4,35 ± 0,13 |
21,1 ± 2,1 |
manuka 6 |
0,58 ± 0,09 |
4,10 ± 0,12 |
19,5 ± 2,0 |
Kwasowość analizowanych miodów, mierzona za pomocą pehametru zawierała się w przedziale od pH = 3,83 dla miodu nawłociowego z Pojezierza Drawskiego do poziomu pH = 4,44 w przypadku miodu nektarowo-spadziowego z Beskidu Żywieckiego. Wszystkie analizowane miody spełniały wymagania określone w normie [Dziennik Ustaw Nr 17, poz. 94, pkt. IX wraz z późn. zm. Dz.U. z 2015 r.], która zaleca kwasowość na poziomie pH = 3,2–4,5, co świadczy o prawidłowym poziomie kwasów organicznych w produkcie, zapewniając odpowiednią trwałość i smak miodu. Również pomiar kwasowości wolnej potwierdził prawidłowy poziom kwasów organicznych; w analizowanych próbkach nie została przekroczona zalecana w normach wartość 50 mval·kg-1. Najwyższą zawartość wolnych kwasów organicznych stwierdzono w miodzie gryczanym z terenów Beskidu Żywieckiego: 37,2 mval·kg-1, a najniższą w miodzie gryczanym z terenów Beskidu Sądeckiego 15,7 mval·kg-1. Nie zanotowano wyraźnej zależności pomiędzy odmianą miodu, regionem i kwasowością próbki.
Barwa to jedna z cech miodu wpływających na wybory konsumenckie. Powiązana jest bezpośrednio z zawartością barwnych związków w pyłku roślin miododajnych, kompozycją pozostałych składników miodu oraz procesami zachodzącymi podczas przechowywania. Istnieje pogląd, że miody o ciemnej barwie wykazują wyższą bioaktywność w porównaniu z miodami jasnymi [Jasicka-Misiak i in., 2012], ze względu na wysoką zawartość ciemnych barwników roślinnych, czyli polifenoli. Teoria ta nie potwierdza się w przypadku niektórych miodów jasnych, na przykład miodu nawłociowego oraz miodów manuka, których bioaktywność wynika z wysokiego poziomu MGO lub wysokiej aktywności enzymatycznej (liczby diastazowej), a nie stężenia barwników roślinnych [Dżugan i in., 2018]. Barwa miodu zależy również od procesów zachodzących podczas przechowywania, ponieważ miód ciemnieje w trakcie przechowywania, w wyniku reakcji Maillarda – reakcji aminokwasów z cukrami w środowisku kwaśnym [Ren i in., 2023], natomiast krystalizacja miodu powoduje jego jaśnienie [Amariei i in., 2020].
Instrumentalny pomiar barwy próbek miodu przeprowadzony został z wykorzystaniem kolorymetru Minolta według systemu C.I.E.L*, a*,b*. W systemie tym możliwe jest ilościowe określenie wybranych składowych barwy produktu: jasności obrazu za pomocą parametru L* (od 0 – czarny do 100 – biały) oraz chromatyczności za pomocą parametrów: a* (od (-)60 – zielony do (+)60 – czerwony) oraz b* (od (-)60 – niebieski do (+)60 – żółty). Jasność ocenianych próbek miodu zawierała się w przedziale L*=20,39–43,84 (Ilustr. 4). Najciemniejszy był miód gryczany 3, natomiast najjaśniejszy – miód nawłociowy 3, oba z obszaru Beskidu Sądeckiego. Zauważono, że w przypadku miodów lipowych, nawłociowych oraz nektarowo-spadziowych, próbki z Beskidu Żywieckiego były ciemniejsze, a próbki z Beskidu Sądeckiego jaśniejsze niż próbki z Pojezierza Drawskiego. Miody manuka pochodzące od trzech różnych producentów charakteryzowały się zbliżoną jasnością L*=32,16-36,41.
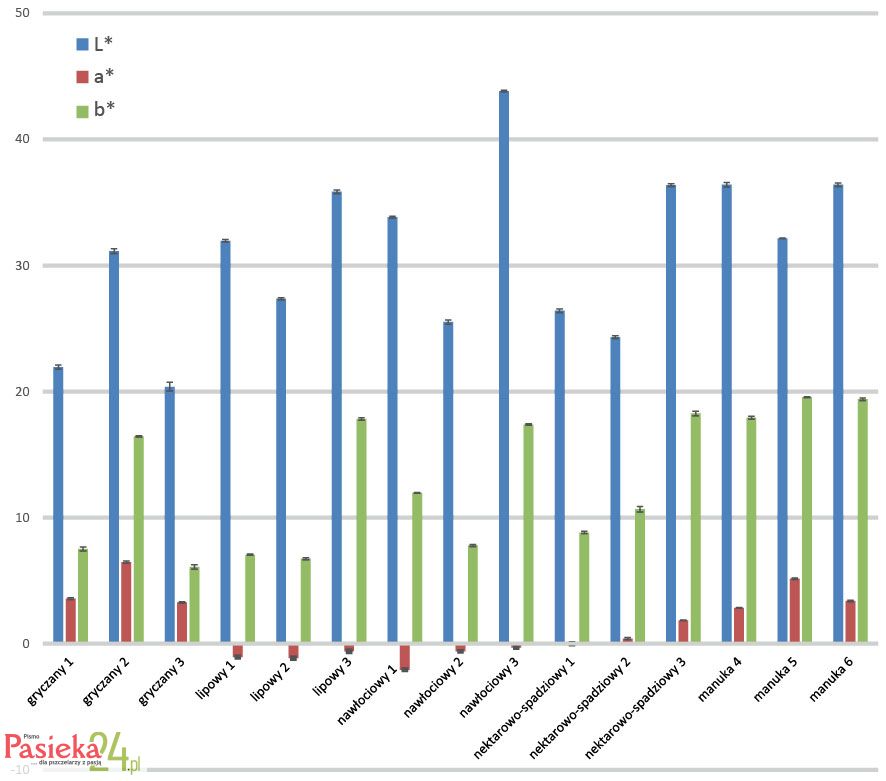
Udział barwy czerwonej w badanych miodach mieścił się w przedziale a* = (-)2,07 - (+)6,47. Miody gryczane oraz manuka charakteryzowały się wyższą zawartością barwników czerwonych niż pozostałe. Nie stwierdzono wyraźnego wpływu regionu na ten parametr barwy. Udział barwy żółtej w próbkach zawierał się w przedziale b* = 6,09-19,56 i najwyższy był w przypadku miodu manuka 5, a najniższy w przypadku miodu gryczanego 3. Nie zanotowano jednoznacznego wpływu regionu pochodzenia miodów polskich na udział barwników żółtych w miodzie, jednak miody: lipowy, nawłociowy oraz nektarowo-spadziowy z Beskidu Sądeckiego miały ich więcej niż pozostałe. W nowozelandzkich miodach manuka zauważono wyższy udział barwników żółtych niż w miodach polskich.
Podsumowanie
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Marta Pasławska1, Maciej Olczyk2, Magdalena Pasławska1
1 - Uniwersytet Przyrodniczy we Wrocławiu
2 - Propharma Warszawa
Literatura:
Janini, Thomas E. Chemistry of Honey. The Ohio State University College of Food, Agricultural, and Environmental Sciences. (2014)
Ajibola, A.; Chamunorwa, J.P.; Erlwanger, K.H. Nutraceutical values of natural honey and its contribution to human health and wealth. Nutr. Metab. 2012, 9, 61
Gkoutzouvelidou, M.;Panos, G.; Xanthou, M.N.;Papachristoforou, A.; Giaouris, E.Comparing the Antimicrobial Actions of Greek Honeys from the Island of Lemnos and Manuka Honey from New Zealand against Clinically Important Bacteria. Proceedings 2021, 70, 8
Nolan, V.C.; Harrison, J.; Cox, J.A.G. Dissecting the antimicrobial composition of honey. Antibiotics 2019, 8, 251
Gomes, S.; Dias, L.G.; Moreira, L.L.; Rodrigues, P.; Estevinho, L. Physicochemical, microbiological and antimicrobial properties of commercial honeys from Portugal. Food Chem. Toxicol. 2010, 48, 544–548
Johnston, M.; McBride, M.; Dahiya, D.; Owusu-Apenten, R.; Nigam, P.S. Antibacterial activity of manuka honey and its components: An overview. AIMS Microbiol. 2018, 4, 655–664
Carter, D.A.; Blair, S.E.; Cokcetin, N.N.; Bouzo, D.; Brooks, P.; Schothauer, R.; Harry, E.J. Therapeutic manuka honey: No longer so alternative. Front. Microbiol. 2016, 7, 569
Maddocks, S.E.; Jenkins, R.E. Honey: A sweet solution to the growing problem of antimicrobial resistance? Future Microbiol. 2013, 8, 1419–1429
Combarros-Fuertes, P.; Fresno, J.M.; Estevinho, M.M.; Sousa-Pimenta, M.; Tornadijo, M.E.; Estevinho, L.M. Honey: Another alternative in the fight against antibiotic-resistant bacteria? Antibiotics 2020, 9, 774
Dyrektywa Unijna 2002/110/WE z dnia 20 grudnia 2001 r.
Dziennik Ustaw Nr 17, poz. 94, pkt. IX wraz z późn. zm. Dz. U. z 2015 r.
Belitz H.D., Grosch W., Schieberle P. Food Chemistry, Springer 4th ed. 2009
Mavric E, Wittmann S, Barth G, Henle T . Identification and quantification of methylglyoxal as the dominant antibacterial constituent of Manuka (Leptospermum scoparium) honeys from New Zealand, Molecular nutrition & food research 2008, 52 (4), 483-489
Martinotti, S.; Ranzato, E. Honey, Wound Repair and Regenerative Medicine. J. Funct. Biomater. 2018, 9, 34
Martinotti, S.; Ranzato, E. Honey’s healing history. In Cellular and Molecular Mechanisms of Honey Wound Healing; Martinotti, R., Ed.; Nova Publishers Inc.: Hauppage, NY, USA, 2014
Da Silva, P.M.; Gauche, C.; Gonzaga, L.V.; Costa, A.C.; Fett, R. Honey: Chemical composition, stability and authenticity. Food Chem. 2016, 196, 309–323
Samarghandian, S.; Farkhondeh, T.; Samini, F. Honey and health: A review of recent clinical research. Pharmacogn. Res. 2017, 9, 121–127
Dżugan M., M. Miłek, E. Sidor, D. Grabek-Lejko. 2020. Apifitoterapia. Synergistyczne działanie miodu i roślin leczniczych. Rzeszów: Oficyna Wydawnicza Zimowit.
Jasicka-Misiak I., A. Poliwoda, M. Dereń. 2012. Phenolic compounds and abscisic acid as potential markers for the floral origin of two Polish unifloral honeys. Food Chemistry 131 (4): 1149-1156
Dżugan M., Tomczyk M., Sowa P., Grabek-Lejko D. 2018. Antioxidant Activity as Biomarker of Honey Variety. Molecules 23 (8): 2069
Ren, C.; Li, Q.; Luo, T.; Betti, M.; Wang, M.; Qi, S.; Wu, L.; Zhao, L. Antioxidant Polyphenols from Lespedeza bicolor Turcz. Honey: Anti-Inflammatory Effects on Lipopolysaccharide-Treated RAW 264.7 Macrophages. Antioxidants 2023, 12, 1809
Amariei S., L. Norocel, L.A. Scripca. 2020. An innovative method for preventing honey crystalization. Innovative Food Science and Emerging Technologies 66 : 102481
1 - Nutraceutyk - składnik w produkcie spożywczym, któremu przypisuje się działanie odżywcze i zdrowotne [za SJP] – przyp. red.



