Miód gryczany pod lupą
Miód gryczany to najciemniejszy odmianowy polski miód nektarowy, otrzymywany z nektaru gryki zwyczajnej (Fagopyrum esculentum Moench) od lipca do sierpnia. W porównaniu z innymi miód gryczany jest szczególnie bogaty w enzymy, żelazo, magnez, zawiera znaczne ilości witaminy C, ponadto wyróżnia się silnymi właściwościami antyoksydacyjnymi oraz bakteriostatycznymi. Cechuje się wysoką aktywnością antybiotyczną wobec gronkowca złocistego i pałeczek Escherichia coli. Miód gryczany wykorzystuje się również do produkcji miodów pitnych i wypieków. Ze względu na ponadprzeciętną zawartość rutyny z powodzeniem stosowany jest w ziołolecznictwie.

Fot. spayder_1979
Charakterystyka pożytku
Gryka (Fagopyrum Mill.) należy do rodziny rdestowatych (Polygonaceae Juss.) i obejmuje 15 gatunków, które rosną w Europie i Azji, w strefie klimatu umiarkowanego [Li 2003]. Gryka zwyczajna (Fagopyrum esculentum Moench) to gatunek zielnej dwuliściennej rośliny jednorocznej o bardzo krótkim okresie wegetacji. Nie wymaga specjalnych warunków glebowych, natomiast jest rośliną ciepłolubną i wrażliwą na najmniejsze przymrozki. Grykę można wysiewać dopiero wtedy, gdy wierzchnia warstwa gleby ogrzeje się do temperatury 8–10°C. Optymalny termin siewu przypada między 15 a 25 maja. Przy odpowiedniej wilgotności i temperaturze (18–22°C) wschody następują po 5–6 dniach. Okres kwitnienia łanu waha się w szerokich granicach od 30 do 70 dni, samych roślin od 30 do 50, a pojedynczego kwiatostanu od 10 do 15 dni [Płażek 2016].
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Owoce gryki to trójkątne niełupki (orzeszki) o ostrych krawędziach, długości 5 mm i grubości 3 mm, nazywane są potocznie ziarnem lub zbożem. Ze względu na podobny skład chemiczny nasion i agrotechnikę uprawy, grykę zwyczajną umownie zalicza się do grupy roślin zbożowych. Nasiona są źródłem pełnowartościowego białka (średnia zwartość 10–16%), z tego względu gryka uprawiana jest głównie w celach konsumpcyjnych (podobnie jak rośliny zbożowe). Wykorzystywana jest do produkcji bezglutenowej kaszy, płatków i otrębów, a zmielone nasiona gryki przerabiane są na mąkę.
MIÓD GRYCZANY
Cechy organoleptyczne
Miód gryczany charakteryzuje się ostrym, specyficznym smakiem podobnym do melasy [Pasini i in. 2013] oraz intensywnym, drażniącym zapachem zbliżonym do kwiatów gryki zwyczajnej. Jako patoka ma barwę jasnobrunatną z wyraźnym odcieniem czerwieni [Kowalska 2012] bądź brązowym lub czekoladowym [Okniański 2006], natomiast w postaci skrystalizowanej przyjmuję barwę zdecydowanie jaśniejszą niż w stanie płynnym.
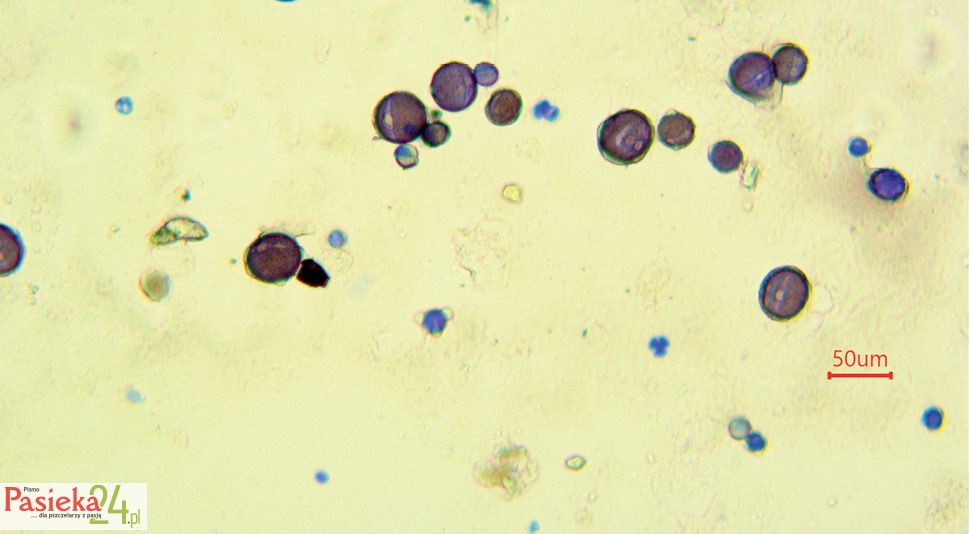
Fot. 5. Typowy osad miodowy miodu gryczanego. Zdjęcie mikroskopowe przy powiększeniu 10×. Preparat barwiony.
Fot. Marta Burzyńska
Skład chemiczny
W miodzie gryczanym znajdują się cukry proste, w przewadze występuje fruktoza (średnio 51%) nad glukozą (średnio 47%), zawartość disacharydu – sacharozy średnio wynosi 0,3%. Chociaż podstawowy skład i profil odżywczy wszystkich rodzajów miodu jest podobny, to miód gryczany odróżnia się na tle pozostałych bogatszym składem, przede wszystkim wyższym stężeniem makroelementów, pierwiastków śladowych oraz witamin. Miód ten bogaty jest w magnez, żelazo, fosfor, miedź, cynk, bor, jod, nikiel i kobalt. Zawiera także sporo witamin, szczególnie kwas askorbinowy (różne źródła podają jego zawartość w granicach od 2,9 do 11,9 mg), również witamin z grupy B, takich jak: tiamina, ryboflawina oraz niacyna [Kędzierska-Matysek i in., 2018; Wilczyńska 2010]. Charakteryzuje się dużą kwasowością. Wyróżnia się wysoką zawartość białka wynoszącą 1,3 mg/g [Burzyńska i in., 2020].
Miód gryczany wykazuje szczególną aktywność enzymatyczną, obecność diastazy (EC 3.2.1.1, α-amylaza), inwertazy (EC 3.2.1.26) oraz katalazy (EC 1.11.1.6) jest zdecydowanie wyższa w porównaniu np. z miodem rzepakowym czy z koniczyny [Čeksteryte 2002]. Związki fenolowe są ważną składową miodów gryczanych. Dowiedziono, że głównymi fenolami w miodzie gryczanym są: kwas kawowy, kwas protokatechowy, kwas p-hydroksybenzoesowy, kwas p-hydroksyfenylooctowy, kwas syringowy, kwas p-kumarowy i kwas ferulowy. Najwyższą zawartością odznacza się przede wszystkim kwas p-hydroksybenzoesowy i p-kumarowy, dlatego też wykorzystuje się te związki do identyfikacji miodu gryczanego w badaniach laboratoryjnych. Ze względu na zdecydowaną ich przewagę nad innymi związkami fenolowymi, traktuje się je jako swoisty odcisk palca dla tej odmiany miodu [Pasini i in., 2013]. W miodzie gryczanym za charakterystyczny aromat odpowiadają konkretne lotne związki, przede wszystkim butanal, 2-metylobutanal i 3-metylobutanal, które odpowiedzialne są za słodki i jednocześnie mdły zapach. Charakterystyczny jest także kwas izowalerianowy, który w literaturze opisywany jest jako zapach spoconych stóp, dlatego został uznany za składnik odpowiedzialny za nieprzyjemny aromat w miodach gryczanych [Shimoda i in., 1996]. Wymienione lotne związki zapachowe traktuje się jako markery do wykrywania pochodzenia miodu i odróżniania od pozostałych odmian [Panseri i in., 2013].
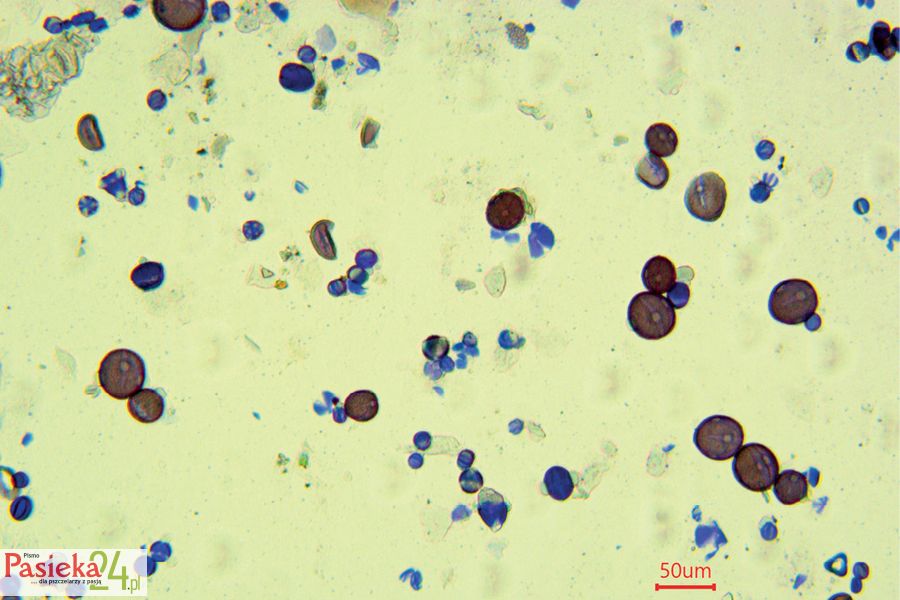
Fot. 6. Typowy osad miodowy miodu gryczanego. Zdjęcie mikroskopowe przy powiększeniu 10×. Preparat barwiony.
Fot. Marta Burzyńska
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Wymagania jakościowe
Wymagania jakościowe dla miodów określa Dyrektywa Parlamentu Europejskiego i Rady 2014/63/UE z dnia 15 maja 2014 r. zmieniająca dyrektywę Rady 2001/110/WE oraz na jej podstawie uchwalone Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 3 października 2003 r. w sprawie szczegółowych wymagań w zakresie jakości handlowej miodu (Dz.U. 2003.181.1773) z późniejszymi zmianami, której wejście w życie uchyliło Polską Normę – Miód Pszczeli (PN-88/A-77626). Natomiast zawartość pyłku w osadzie miodowym wymagane dla miodu gryczanego (nie mniej niż 45%) nadal określa Polska Norma (PN-88/A-77626, 1998) – tabela 2. Poniżej zebrane zostały szczegółowe wymagania w zakresie jakości handlowej polskich miodów, ze szczególnym uwzględnieniem dla miodu gryczanego (tab. 1).
Tabela 1. Wymagania jakościowe dla miodu gryczanego na podstawie Dz.U. 2015 poz. 850; PN-88/A-77626:1988
|
Badana substancja |
Kryteria |
|
Zawartość wody |
nie więcej niż 20% |
|
Zawartość fruktozy i glukozy (suma fruktozy i glukozy) |
nie mniej niż 60 g/100 g |
|
Zawartość sacharozy |
nie więcej niż 5 g/100 g |
|
Zawartość substancji nierozpuszczalnych w wodzie |
nie więcej niż: 0,1 g/100 g |
|
Przewodność właściwa |
nie więcej niż 0,8 mS/cm |
|
Wolne kwasy |
nie więcej niż 50 mval/kg |
|
Liczba diastazowa |
nie mniej niż 8 |
|
Zawartość 5-hydroksymetylofurfuralu (HMF) |
nie więcej niż 40 mg/kg |
|
Analiza pyłkowa |
Rozporządzenia Ministra Rolnictwa i Rozwoju Wsi z dnia 14.01.2009 r. (Dz. U. Nr 17, poz. 94) pkt. VI i PN-88/A-77626 Miód pszczeli Nie mniej niż 45% udziału pyłku Fagopyrum esculentum |
Budowa pyłku na przykładzie Fagopyrum esculentum
Charakterystyczna budowa kwiatów gryki zwyczajnej powoduje, że owad szukający nektaru jest obrzucany pyłkiem z obu stron, ze względu na pękanie wewnętrznych okółek pręcików na zewnątrz, a zewnętrznych do wewnątrz. Dwa rodzaje kwiatów powodują produkcję ziaren pyłku o różnej wielkości. Ziarna pyłku kwiatów Thrum są większe od produkowanych przez kwiaty typu Pin [Namai i Fujita 1995]. Określono długość ziaren pyłku w kwiatach typu Pin w przedziale od 17,58–58,05 μm, a w typie Thrum w zakresie 19,35–63,86 μm [Brindza i in., 2015]. Ziarno pyłku gryki jest owalne, z trzema wypustkami. Egzyna o grubości 3 μm ma dość nieregularną powierzchnię z małymi wgłębieniami (fot. 2).
Zawartość ziaren pyłku gryki w powietrzu i w miodach gryczanych
Uzyskanie jednoodmianowego miodu gryczanego jest bardzo trudne, dlatego też występuje głównie w krajach z wysokimi wskaźnikami produkcji gryki, m.in. w Chinach, Rosji, na Ukrainie, a także w Polsce [Popović i in., 2014]. Najwyższy zakres procentowego udziału pyłku gryki zwyczajnej zawiera Polska Norma (PN-88/A-77626:1988 ), w pozostałych krajach, w których pozyskuje się miód gryczany, najwyższa granica to 30% [Beckh i Camps 2009], podczas gdy polski miód gryczany musi zawierać nie mniej niż 45% pyłku pochodzącego od Fagopyrum esculentum, aby prawnie mógł być nazwany miodem gryczanym.
Tabela 2. Minimalny procentowy udział pyłku przewodniego w odmianowych miodach nektarowych zgodnie z PN-88/A-77626:1988
|
Odmiana miodu |
Minimalny procentowy udział |
|
Rzepakowy (Brassica napus) |
45 |
|
Akacjowy (Robinia pseudoacacia) |
30 |
|
Lipowy (Tilia sp.) |
20 |
|
Gryczany (Fagopyrum esculentum) |
45 |
|
Wrzosowy (Calluna vulgaris) |
45 |
|
Wielokwiatowy |
Bez pyłku przewodniego |
Właściwości zdrowotne
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
mgr inż. Marta Burzyńska
Katedra Biochemii i Analizy Żywności
Wydział Nauk o Żywności i Żywieniu
Uniwersytet Przyrodniczy w Poznaniu
Literatura:
Adachi T., Kawabata K., Matsuzaki N.,Observation of pollen tube elongation, fertilization and ovule development in autogamous autotetraploid buckwheat;1983; Proc. 2nd Int. Symp. Buckwheat Miyazaki Buckwheat Research: s. 103-113.
Baczmiański J., Gruszczyński R., Miód to zdrowie. Ekonatura; 2008;10, s. 8-9.
Blasa M., Candiracci M., Accorsi A., Piacentini M.P., Albertini M.C., Piatti E. Raw millefiori honey is packed full of antioxidants. Food Chem. 2006;97:217–222. doi: 10.1016/j.foodchem.2005.03.039
Bogdanov S., Haldimann, M., Luginbühl, W., Gallmann, P., Minerals in honey: Environmental, geographical and botanical aspects. Journal of Apicultural Research and Bee World; 2007; 46(4), s. 269–275.
Brindza J., Schubertova Z., Brovarskyi V, Motyleva S, Mertvischeva M, Grygorieva O., Morphological characteristics of common Buckwheat (Fagopyrum Esculentum Moench) pollen grains and bee pollen; 2015. - Вип. 223. – С, s. 17-24.
Brudzyński K., AbubakerK., Wang T., Powerful bacterial killing by buckwheat honeys is concentration-dependent, involves complete DNA degradation and requires hydrogen peroxide. Frontiers in Microbiology;2012; 3(242), s. 1–9.
Burzyńska M., Piasecka-Kwiatkowska D., Springer E., Allergenic properties of Polish nectar honeys. Acta scientiarumpolonorum. Technologia alimentaria;2020; 19(1), s. 15–24.
Cawoy V., Ledent J-F., Kinet J-M., Jacquemart A-L., Floral biology of common buckwheat (Fagopyrum esculentumMoench. The Eaupoen Journal of Plant Science and Biotechnology 3; 2009; s. 1-9.
Čeksteryte V., Investigation of pollen composition and catalase activity in unifloral summer and polyfloral spring honey. Zemdirbyste-Agriculture, ٨٠, ٢٠٠٢, s. ١٩٣–٢٠٠.
Cheng N., Wang Y., Cao W., The protective effect of whole honey and phenolic extract on oxidative DNA damage in mice lymphocytes using comet assay. Plant Foods for Human Nutrition; 2017; 72, s. 388–395.
Deng J., Liu R., Lu Q., Hao P., Xu A., Zhang J., Tan J., Biochemical properties, antibacterial and cellular antioxidant activities of buckwheat honey in comparison to manuka honey. Food chemistry, 2018; 252, s. 243–249.
Feás X., PilarVázquez-Tato M., Estevinho L., Organic bee pollen: botanical origin, nutritional value, bioactive compounds, antioxidant activity and microbiological quality. Molecules; 2012; 17, s. 8359-8377.
García-Tenesaca M., Navarrete E. S., Iturralde, G. A., VillacrésGranda, I. M., Tejera, E., Beltrán-Ayala, P., et al., Influence of botanical origin and chemical composition on the protective effect against oxidative damage and the capacity to reduce in vitro bacterial biofilms of monofloral honeys from the Andean region of Ecuador. International Journal of Molecular Sciences; 2018; 19(1), s. 45.
Gheldof N., Wang X. H., EngesethN. J., Identification and quantification of antioxidant components of honeys from various floral sources. Journal of Agricultural and Food Chemistry; 2002; 50, s. 5870–5877.
Gheldof N., Wang X. H., Engeseth N. J., Buckwheat honey increases serum antioxidant capacity in humans. Journal of Agricultural and Food Chemistry,2003; 51, s. 1500–1505
Giménez-Bastida, J. A., Zieliński, H.,Buckwheat as a functional food and its effects on health. Journal of Agricultural and Food Chemistry, 2015;63, s. 7896–7913.
Jabłoński B., Potrzeby zapylania i wartość pszczelarska owadopylnych roślin uprawnych. Oddział Pszczelnictwa ISK; 1997;Puławy.
Kędzierska-Matysek M., Florek M., Wolanciuk A., Barłowska J., Litwińczuk Z., Concentration of Minerals in Nectar Honeys from Direct Sale and Retail in Poland. Biol Trace Elem Res. 2018;186(2), s. 579-588.
Kowalska J., Majewska E., Owerko B., Fizykochemiczne parametry wybranych miodów gryczanych dostępnych na rynku polskim, Bromatologia i Chemia Toksykologiczna, 2012, 4: s. 1233-1238.
Kwakman P. H., Zaat S. A.,. Antibacterial components of honey, 2012, IUBMB Life, 64(1), s. 448–455.
Li A. R., Fagopyrum, 2003, Flora of China; Science Press and the Missouri Botanical Garden Press: Beijing, China.
ShimodaM., WuY., OsajimaY., Aroma compounds from aqueous solution of haze (Rhus succedanea) honey determined by adsorptive column chromatography, Journal of Agricultural and Food Chemistry, 1996, vol. 44, no. 12, s. 3913–3918.
Namai H., Fujita Y., Floral characteristics associated with seed productivity in common buckwheat, Fagopyrum esculentum Moench. In: Current Advances in Buckwheat Research. Proceedings of the 6th International Symposium on Buckwheat; 1995;Shinshu, Japan, 24–29 August 1995. (Matamo, T. and Ujihara, A., Eds.). Shinshu University Press, Shinshu, Japan. S. 425–435.
Okniański P., Polskie płynne złoto. Miody odmianowe. Pasieka, 2006; 5;s. 14-17.
Panseri S., Manzo A., Chiesa L. M., Giorgi A.,Melissopalynological and volatile compounds analysis of buckwheat honey from different geographical origins and their role in botanical determination. Journal of Chemistry, 2013, J. Chem. 2013, 2013, s. 1–11.
Pasini F., Gardini S., Marcazzan G. L., Caboni, M. F.,. Buckwheat honeys: Screening of composition and properties. Food Chemistry, 2013, 141, s. 2802–2811.
Paul I. M., Beiler J., McMonagle A., Shaffer M. L., Duda L., Berlin C. M., Jr., Effect of honey, dextromethorphan, and no treatment on nocturnal cough and sleep quality for coughing children and their parents. Archives of Pediatrics and Adolescent Medicine, 2007; 161, s. 1140–1146.
Płażek A., Badanie możliwości zwiększenia żywotności i stopnia zapylenia kwiatów gryki zwyczajnej w celu uzyskania wyższego plonu nasion, Streszczenie raportu rocznego z realizacji projektu MRiRWHORhn – 801 – PB – 5/16 zadanie nr 37, Katedra Fizjologii Roślin, Wydział Rolniczo-Ekonomiczny UR w Krakowie.
Popović V, Sikora V, Berenji J, Filipović V, Dolijanović Ž, Ikanović J, Dončić D. 2014 Analysis of buckwheat production in the world and Serbia. Agric. Econ. 61, s. 53–62.
Škrabanja, V., Kreft, I., Germ, M., Screening of common buckwheat genetic resources for recessive genes. In Buckwheat Germplasm in the World; (٢٠١٨)Zhou, M., Kreft, I., Suvorova, G., Tang, Y.,Woo, S.H., Eds.; Academic Press, An Imprint of Elsevier: London, UK; s. ١٢٧–١٤٣
Wilczyńska, A., Phenolic content and antioxidant activity of different types of polish honey: A short report. Polish Journal of Food and Nutrition Sciences, 2010, 60(4), s. 309–313.
Woo S.H., Ohmoto T., Campbell C., Adachi T., Jong S.K.. Pre- and post-fertilization to backcrossing in interspecific hybridization between Fagopyrum esculentum and F. homotropicum with F. esculentum,2001, The proceeding of the 8th, s. 450-455.
Wyłupek T., Powroźnik M., Widelska M., Album roślin miododajnych, Wojewódzki Inspektorat Ochrony Roślin i Nasiennictwa w Lublinie, Lubin 2020, s. 46-47.



