Miody nektarowe
Miód gryczany pod lupą
Miód gryczany to najciemniejszy odmianowy polski miód nektarowy, otrzymywany z nektaru gryki zwyczajnej (Fagopyrum esculentum Moench) od lipca do sierpnia. W porównaniu z innymi miód gryczany jest szczególnie bogaty w enzymy, żelazo, magnez, zawiera znaczne ilości witaminy C, ponadto wyróżnia się silnymi właściwościami antyoksydacyjnymi oraz bakteriostatycznymi. Cechuje się wysoką aktywnością antybiotyczną wobec gronkowca złocistego i pałeczek Escherichia coli. Miód gryczany wykorzystuje się również do produkcji miodów pitnych i wypieków. Ze względu na ponadprzeciętną zawartość rutyny z powodzeniem stosowany jest w ziołolecznictwie.

Charakterystyka pożytku
Gryka (Fagopyrum Mill.) należy do rodziny rdestowatych (Polygonaceae Juss.) i obejmuje 15 gatunków, które rosną w Europie i Azji, w strefie klimatu umiarkowanego [Li 2003]. Gryka zwyczajna (Fagopyrum esculentum Moench) to gatunek zielnej dwuliściennej rośliny jednorocznej o bardzo krótkim okresie wegetacji. Nie wymaga specjalnych warunków glebowych, natomiast jest rośliną ciepłolubną i wrażliwą na najmniejsze przymrozki. Grykę można wysiewać dopiero wtedy, gdy wierzchnia warstwa gleby ogrzeje się do temperatury 8–10°C. Optymalny termin siewu przypada między 15 a 25 maja. Przy odpowiedniej wilgotności i temperaturze (18–22°C) wschody następują po 5–6 dniach. Okres kwitnienia łanu waha się w szerokich granicach od 30 do 70 dni, samych roślin od 30 do 50, a pojedynczego kwiatostanu od 10 do 15 dni [Płażek 2016].
Gryka jest rośliną owadopylną, w 80–90% zapylaną przez pszczoły miodne [Jabłoński 1997; Škrabanja 2018]. Duży wpływ na zapylanie i wiązanie nasion mają warunki pogodowe w czasie kwitnienia – długotrwałe opady deszczu powodują wymywanie nektaru (nektarniki gryki są otwarte), co powoduje, że oblot przez pszczoły jest niewystarczający do zapylenia. Zbyt wysokie temperatury i susze powodują, że znamię słupka szybko zasycha, pyłek lub łagiewka pyłkowa zamierają i nie dochodzi do zapłodnienia, natomiast powstałe już zawiązki nie rozwijają się w nasiona. W okresie letnim, ale także jesiennym, pola uprawne gryki zwyczajnej spełniające m.in. rolę międzyplonów, są atrakcyjnym pożytkiem dla pszczół. Wydajność miodowa gryki wynosi ok. 300 kg/ha, wydajność pyłkowa ok. 25 kg/ha [Wyłupek i in. 2020].
Wielkość siewu w przeliczeniu na obszar wynosi 70 kg/ha na glebach lepszych oraz 80 kg/ha na słabszych. Jednak gdy siew odbywa się w opóźnionym terminie, należy zwiększyć ilość wysiewanych nasion o 10 kg/ha. Gryka doskonale rośnie w trudnych warunkach środowiskowych, wykazując wysoką odporność na szkodniki i choroby. Jest neutralna w płodozmianie. Roślina ta uprawiana jest także jako letni międzyplon na nawóz zielony, poprawiający strukturę i żyzność gleby. Gryka jest rośliną fitosanitarną, ponieważ jej uprawa pozwala ograniczyć zachwaszczenie gleby oraz występowanie w niej niektórych nicieni. Jest stosowana również w mieszankach jako roślina pastewna, a także wysiewana jako pokarm dla dzikiej zwierzyny.
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Głównymi powodami słabego zawiązywania nasion jest samoniezgodność wynikająca z dwupostaciowych kwiatów różniących się długością pręcików i słupków w kwiatach (różnosłupkowość) oraz wadliwego rozwoju woreczków zalążkowych [Woo i in. 2001]. U gryki występują dwa rodzaje kwiatów: typ Thrum – z długimi pręcikami i krótkim słupkiem oraz Pin – z wysokim słupkiem i niskimi pręcikami. Z tego względu kwiaty gryki zwyczajnej wymagają wielokrotnych odwiedzin przez owady zapylające, aby przenieść właściwy pyłek na znamię słupka. Gryka jest rośliną samoniekończącą, to znaczy, że rośliny kwitną do samego końca okresu wegetacji i wykazują się wysoką „nadprodukcją” liczby kwiatów w stosunku do liczby zawiązanych nasion. Jedna roślina wytwarza 500–2000 kwiatów, jednak tylko 4–10% z nich wykształca nasiona. Jest to przyczyną silnej konkurencji o asymilaty pomiędzy zawiązanymi nasionami, a wciąż nowo powstającymi kwiatami [Płażek 2016].
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
MIÓD GRYCZANY
Cechy organoleptyczne
Miód gryczany charakteryzuje się ostrym, specyficznym smakiem podobnym do melasy [Pasini i in. 2013] oraz intensywnym, drażniącym zapachem zbliżonym do kwiatów gryki zwyczajnej. Jako patoka ma barwę jasnobrunatną z wyraźnym odcieniem czerwieni [Kowalska 2012] bądź brązowym lub czekoladowym [Okniański 2006], natomiast w postaci skrystalizowanej przyjmuję barwę zdecydowanie jaśniejszą niż w stanie płynnym.
Fot. Marta Burzyńska
Skład chemiczny
W miodzie gryczanym znajdują się cukry proste, w przewadze występuje fruktoza (średnio 51%) nad glukozą (średnio 47%), zawartość disacharydu – sacharozy średnio wynosi 0,3%. Chociaż podstawowy skład i profil odżywczy wszystkich rodzajów miodu jest podobny, to miód gryczany wyróżnia się na tle pozostałych wyższym stężeniem makroelementów, pierwiastków śladowych oraz witamin. Miód ten bogaty jest w magnez, żelazo, fosfor, miedź, cynk, bor, jod, nikiel i kobalt. Zawiera także sporo witamin, szczególnie kwas askorbinowy (różne źródła podają jego zawartość w granicach od 2,9 do 11,9 mg), również witamin z grupy B, takich jak: tiamina, ryboflawina oraz niacyna [Kędzierska-Matysek i in., 2018; Wilczyńska 2010]. Charakteryzuje się dużą kwasowością. Wyróżnia się wysoką zawartością białka wynoszącą 1,3 mg/g [Burzyńska i in., 2020].
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Fot. Marta Burzyńska
Miód gryczany ponadto cechuje się znaczną aktywnością antybiotyczną [Hołderna-Kędzia2001]. Dowiedziono, że wyróżnia się szczególnie silnym działaniem antybakteryjnym [Paul i in., 2007] i przeciwutleniającym [Gheldof i in., 2002]. Wysoka aktywność antydrobnoustrojowa miodu gryczanego jest wynikiem synergistycznego działania enzymów (oksydaza glukozowa, katalaza), a także aktywnych związków fenolowych oraz antyoksydacyjnych (kwasy fenolowe, flawonoidy, kwas askorbinowy). Działanie to potęguje obecność kwasów organicznych, metyloglioksalu oraz antybakteryjnego białka odpszczelego: defensyny-1 [García-Tenesacai in., 2018; Kwakman i Zaat 2012]. Ten oryginalny skład miodu gryczanego, a szczególnie obecność produktu rozpadu oksydazy glukozowej – nadtlenku wodoru (H2O2) oraz związków fenolowych, flawonoidów, takich jak hesperetyna i rutyna, wpływa na wysoką aktywność przeciwutleniającą [Cheng i in., 2017]. Miód gryczany w swoim składzie zawiera wszystkie niezbędne substraty do reakcji Fentona1 i to w wysokich stężeniach, m.in. nadtlenek wodoru (H2O2), wytwarzany przez oksydazę glukozową, polifenole i jony metali przejściowych [Bogdanov i in., 2007]. Ta reakcja sprzęgania jest związana z działaniem bakteriostatycznym miodu gryczanego. Brudzyński i in. [2012] w swojej pracy badawczej dowiedli, że miody o wysokiej aktywności przeciwdrobnoustrojowej mają znacznie wyższe poziomy związków fenolowych, które wykazują silne właściwości zmiatania wolnych rodników. Dodatkowo polifenole jako silne prooksydanty mogą potęgować generowanie znacznych ilości nadtlenku wodoru (H2O2), który w obecności jonów metali przejściowych obecnych w miodzie gryczanym, takich jak: jony żelaza na drugim stopniu utlenienia (Fe2+) lub miedzi na pierwszym stopniu utleniania (Cu+), można przekształcić w rodniki hydroksylowe za pomocą reakcji Fentona. Wysoka zawartość związków fenolowych oraz antyoksydacyjnych, które w połączeniu z różnymi mechanizmami (np. reakcją Fentona) wpływają na silną aktywność przeciwbakteryjną oraz przeciwutleniającą, dlatego też w wielu badaniach porównujących właściwości miodów, miody gryczane uzyskują lepsze wyniki nawet od popularnego miodu manuka [Deng i in., 2018].
Wymagania jakościowe
Wymagania jakościowe dla miodów określa Dyrektywa Parlamentu Europejskiego i Rady 2014/63/UE z dnia 15 maja 2014 r. zmieniająca dyrektywę Rady 2001/110/WE oraz na jej podstawie uchwalone Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 3 października 2003 r. w sprawie szczegółowych wymagań w zakresie jakości handlowej miodu [Dz.U. 2003.181.1773] z późniejszymi zmianami, której wejście w życie uchyliło Polską Normę – Miód pszczeli (PN-88/A-77626). Natomiast zawartość pyłku w osadzie miodowym wymagane dla miodu gryczanego (nie mniej niż 45%) nadal określa Polska Norma (PN-88/A-77626, 1998) – Tabela 2. Poniżej zebrane zostały szczegółowe wymagania w zakresie jakości handlowej polskich miodów, ze szczególnym uwzględnieniem dla miodu gryczanego (Tabela 1).
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
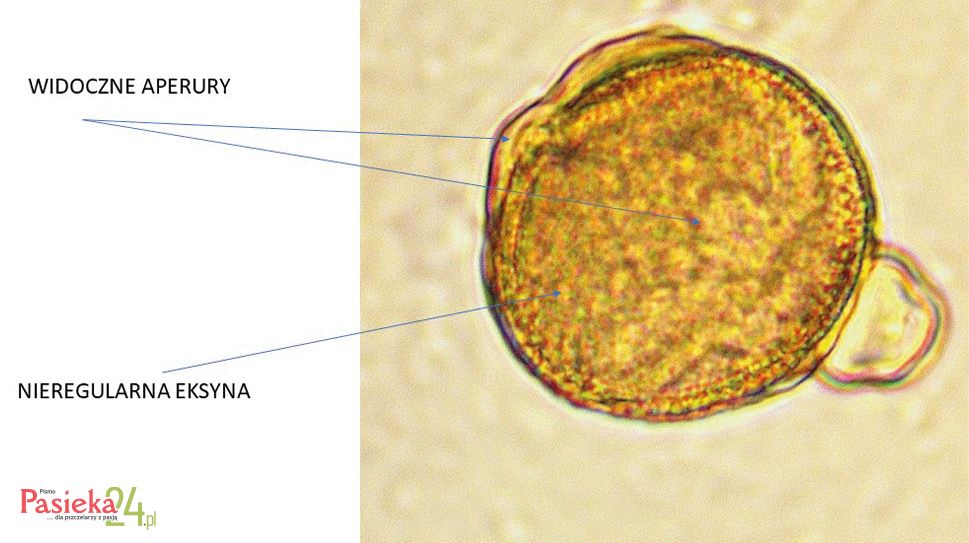
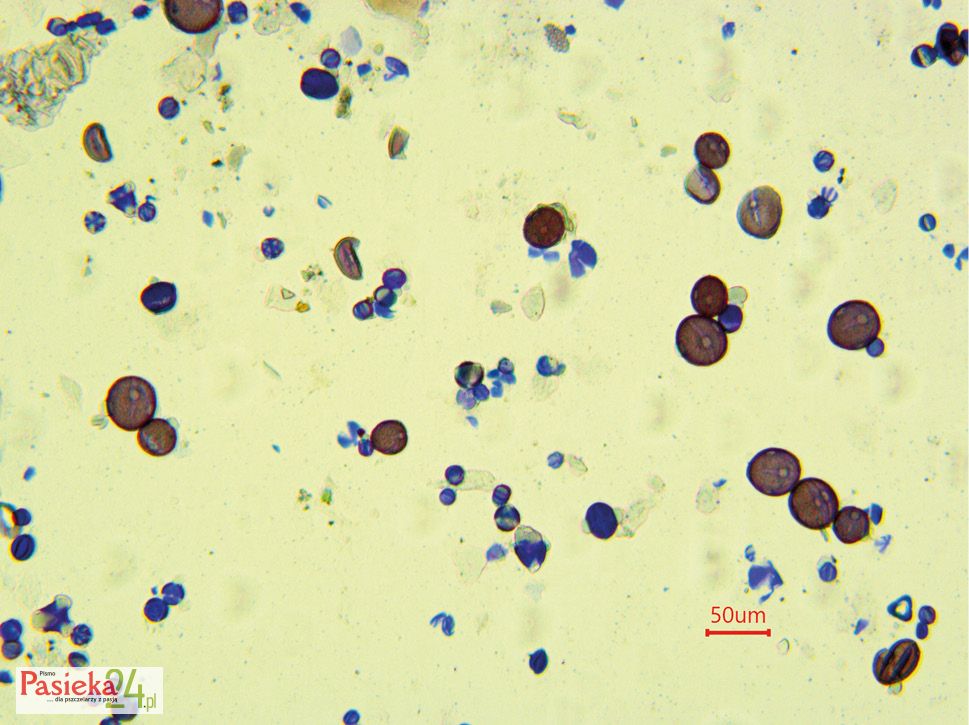
Budowa pyłku na przykładzie Fagopyrum esculentum
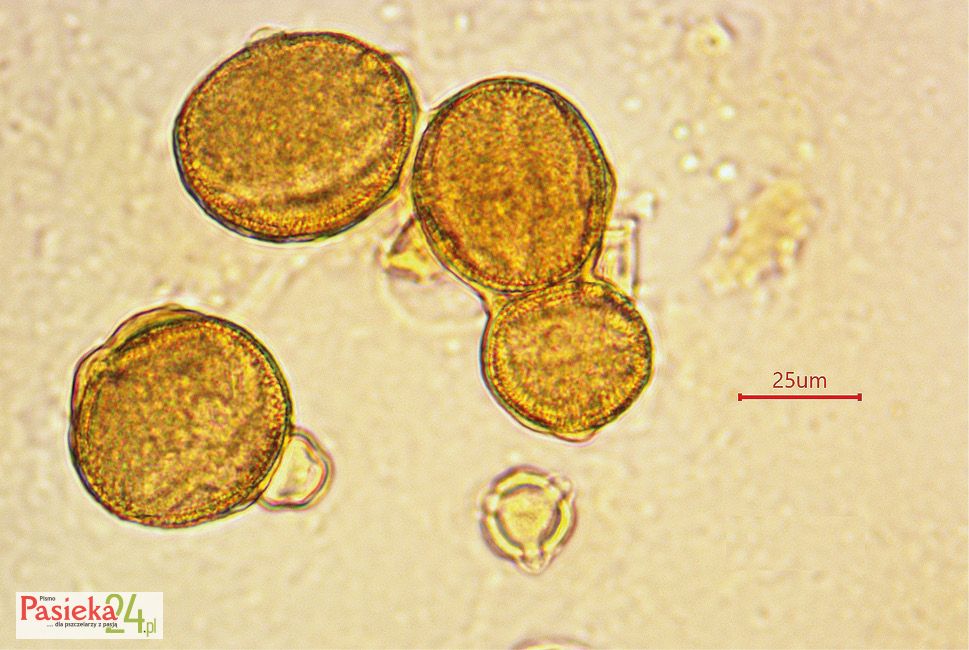
Charakterystyczna budowa kwiatów gryki zwyczajnej powoduje, że owad szukający nektaru jest obrzucany pyłkiem z obu stron, ze względu na pękanie wewnętrznych okółek pręcików na zewnątrz, a zewnętrznych do wewnątrz. Dwa rodzaje kwiatów powodują produkcję ziaren pyłku o różnej wielkości. Ziarna pyłku kwiatów Thrum są większe od produkowanych przez kwiaty typu Pin [Namai i Fujita 1995]. Określono długość ziaren pyłku w kwiatach typu Pin w przedziale od 17,58–58,05 μm, a w typie Thrum w zakresie 19,35–63,86 μm [Brindza i in., 2015]. Ziarno pyłku gryki jest owalne, z trzema wypustkami. Egzyna o grubości 3 μm ma dość nieregularną powierzchnię z małymi wgłębieniami (Fot. 2).
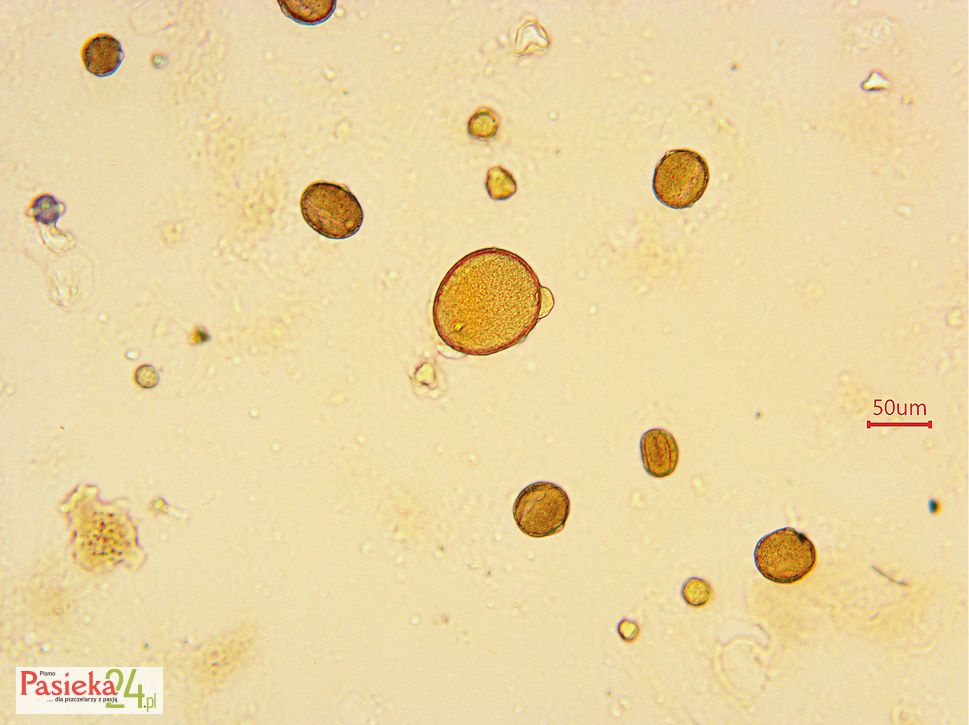
Zawartość ziaren pyłku gryki w powietrzu i w miodach gryczanych
Uzyskanie jednoodmianowego miodu gryczanego jest bardzo trudne, dlatego też występuje głównie w krajach z wysokimi wskaźnikami produkcji gryki, m.in. w Chinach, Rosji, na Ukrainie, a także w Polsce [Popović i in., 2014]. Najwyższy zakres procentowego udziału pyłku gryki zwyczajnej zawiera Polska Norma (PN-88/A-77626:1988 ), w pozostałych krajach, w których pozyskuje się miód gryczany, najwyższa granica to 30% [Beckh i Camps 2009], podczas gdy polski miód gryczany musi zawierać nie mniej niż 45% pyłku pochodzącego od Fagopyrum esculentum, aby prawnie mógł być nazwany miodem gryczanym.
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Właściwości zdrowotne

Ze względu na zawartość rutyny miód gryczany polecany jest szczególnie w prewencji chorób układu sercowo-naczyniowego. Poprawia elastyczność, wytrzymałość i przepuszczalność ścian naczyń włosowatych. Dzięki temu zapobiega pękaniu naczyń krwionośnych, powstawaniu wybroczyn oraz wylewów. Kolejną korzyścią płynącą ze spożywania miodu gryczanego jest zdolność do hamowania procesów miażdżycowych. Ważną rolę odgrywa też w leczeniu niedokrwistości wynikającej m.in. z niedoboru żelaza, ponieważ wykazano, że regularne spożywanie miodu gryczanego zwiększa stężenie hemoglobiny we krwi. Działa osłonowo i detoksykacyjnie na wątrobę, co wynika ze znacznej ilości łatwo przyswajalnych cukrów prostych. Z tego samego względu sprzyja regeneracji wyczerpanego chorobami organizmu. Może być stosowany w cukrzycy niezależnej od insuliny. Istnieją dane ukazujące, że miód ten wspomaga odbudowę kości po złamaniach, jak również jest pomocny w profilaktyce chorób nowotworowych [Hołderna-Kędzia 2001]. Poza tym wskazany jest w infekcjach przebiegających z gorączką, zaburzeniach wzroku, osłabienia słuchu i problemach z pamięcią [Baczmiański i Gruszczyński 2008; Feás i in. 2012]. W swoim składzie zawiera dobrze przyswajalne żelazo, białka i witaminę C, dzięki czemu jest pomocny w leczeniu chorób układu oddechowego, leczeniu niedokrwistości oraz zaburzeń na tle nerwowym. Wśród wszystkich do tej pory przebadanych miodów ta odmiana jest najbogatszym źródłem przeciwutleniaczy, jakie mogą zmniejszać stres oksydacyjny wywołany przez reaktywne formy tlenu (RFT) [Gheldof i in. 2003]. Ponadto stwierdzono, że miód pomaga obniżyć poziom cholesterolu we krwi, co może wzmocnić pracę serca, a nawet obniżyć podwyższone ciśnienie krwi [Giménez-Bastidai Zieliński 2015]. Dodatkowo jest skuteczniejszy w przypadku infekcji dróg oddechowych, takich jak przeziębienia, bardziej niż niektóre leki przeciwkaszlowe [Paul i in., 2007]. Węglowodany wraz z fenolami zawartymi w składzie miodu mogą wspomagać hamowanie potencjalnie szkodliwych bakterii mikroflory jelitowej. Z tego względu miód gryczany może być stosowany w leczeniu różnych chorób przewodu pokarmowego i wpływać korzystanie na prawidłowy rozwój mikrobioty jelitowej [Blasai in., 2006].

Literatura
1. Adachi T., Kawabata K., Matsuzaki N.,Observation of pollen tube elongation, fertilization and ovule development in autogamous autotetraploid buckwheat;1983; Proc. 2nd Int. Symp. Buckwheat Miyazaki Buckwheat Research: s. 103-113.
2. Baczmiański J., Gruszczyński R., Miód to zdrowie. Ekonatura; 2008;10, s. 8-9.
3. Blasa M., Candiracci M., Accorsi A., Piacentini M.P., Albertini M.C., Piatti E. Raw millefiori honey is packed full of antioxidants. Food Chem. 2006;97:217–222. doi: 10.1016/j.foodchem.2005.03.039
4. Bogdanov S., Haldimann, M., Luginbühl, W., Gallmann, P., Minerals in honey: Environmental, geographical and botanical aspects. Journal of Apicultural Research and Bee World; 2007; 46(4), s. 269–275.
5. Brindza J., Schubertova Z., Brovarskyi V, Motyleva S, Mertvischeva M, Grygorieva O., Morphological characteristics of common Buckwheat (Fagopyrum Esculentum Moench) pollen grains and bee pollen; 2015. - Вип. 223. – С, s. 17-24.
6. Brudzyński K., AbubakerK., Wang T., Powerful bacterial killing by buckwheat honeys is concentration-dependent, involves complete DNA degradation and requires hydrogen peroxide. Frontiers in Microbiology;2012; 3(242), s. 1–9.
7. Burzyńska M., Piasecka-Kwiatkowska D., Springer E., Allergenic properties of Polish nectar honeys. Acta scientiarumpolonorum. Technologia alimentaria;2020; 19(1), s. 15–24.
8. Cawoy V., Ledent J-F., Kinet J-M., Jacquemart A-L., Floral biology of common buckwheat (Fagopyrum esculentumMoench. The Eaupoen Journal of Plant Science and Biotechnology 3; 2009; s. 1-9.
9. Čeksteryte V., Investigation of pollen composition and catalase activity in unifloral summer and polyfloral spring honey. Zemdirbyste-Agriculture, 80, 2002, s. 193–200.
10. Cheng N., Wang Y., Cao W., The protective effect of whole honey and phenolic extract on oxidative DNA damage in mice lymphocytes using comet assay. Plant Foods for Human Nutrition; 2017; 72, s. 388–395.
11. Deng J., Liu R., Lu Q., Hao P., Xu A., Zhang J., Tan J., Biochemical properties, antibacterial and cellular antioxidant activities of buckwheat honey in comparison to manuka honey. Food chemistry, 2018; 252, s. 243–249.
12. Feás X., PilarVázquez-Tato M., Estevinho L., Organic bee pollen: botanical origin, nutritional value, bioactive compounds, antioxidant activity and microbiological quality. Molecules; 2012; 17, s. 8359-8377.
13. García-Tenesaca M., Navarrete E. S., Iturralde, G. A., VillacrésGranda, I. M., Tejera, E., Beltrán-Ayala, P., et al., Influence of botanical origin and chemical composition on the protective effect against oxidative damage and the capacity to reduce in vitro bacterial biofilms of monofloral honeys from the Andean region of Ecuador. International Journal of Molecular Sciences; 2018; 19(1), s. 45.
14. Gheldof N., Wang X. H., EngesethN. J., Identification and quantification of antioxidant components of honeys from various floral sources. Journal of Agricultural and Food Chemistry; 2002; 50, s. 5870–5877.
15. Gheldof N., Wang X. H., Engeseth N. J., Buckwheat honey increases serum antioxidant capacity in humans. Journal of Agricultural and Food Chemistry,2003; 51, s. 1500–1505
16. Giménez-Bastida, J. A., Zieliński, H.,Buckwheat as a functional food and its effects on health. Journal of Agricultural and Food Chemistry, 2015;63, s. 7896–7913.
17. Jabłoński B., Potrzeby zapylania i wartość pszczelarska owadopylnych roślin uprawnych. Oddział Pszczelnictwa ISK; 1997;Puławy.
18. Kędzierska-Matysek M., Florek M., Wolanciuk A., Barłowska J., Litwińczuk Z., Concentration of Minerals in Nectar Honeys from Direct Sale and Retail in Poland. Biol Trace Elem Res. 2018;186(2), s. 579-588.
19. Kowalska J., Majewska E., Owerko B., Fizykochemiczne parametry wybranych miodów gryczanych dostępnych na rynku polskim, Bromatologia i Chemia Toksykologiczna, 2012, 4: s. 1233-1238.
20. Kwakman P. H., Zaat S. A.,. Antibacterial components of honey, 2012, IUBMB Life, 64(1), s. 448–455.
21. Li A. R., Fagopyrum, 2003, Flora of China; Science Press and the Missouri Botanical Garden Press: Beijing, China.
22. ShimodaM., WuY., OsajimaY., Aroma compounds from aqueous solution of haze (Rhus succedanea) honey determined by adsorptive column chromatography, Journal of Agricultural and Food Chemistry, 1996, vol. 44, no. 12, s. 3913–3918.
23. Namai H., Fujita Y., Floral characteristics associated with seed productivity in common buckwheat, Fagopyrum esculentum Moench. In: Current Advances in Buckwheat Research. Proceedings of the 6th International Symposium on Buckwheat; 1995;Shinshu, Japan, 24–29 August 1995. (Matamo, T. and Ujihara, A., Eds.). Shinshu University Press, Shinshu, Japan. S. 425–435.
24. Okniański P., Polskie płynne złoto. Miody odmianowe. Pasieka, 2006; 5;s. 14-17.
25. Panseri S., Manzo A., Chiesa L. M., Giorgi A.,Melissopalynological and volatile compounds analysis of buckwheat honey from different geographical origins and their role in botanical determination. Journal of Chemistry, 2013, J. Chem. 2013, 2013, s. 1–11.
26. Pasini F., Gardini S., Marcazzan G. L., Caboni, M. F.,. Buckwheat honeys: Screening of composition and properties. Food Chemistry, 2013, 141, s. 2802–2811.
27. Paul I. M., Beiler J., McMonagle A., Shaffer M. L., Duda L., Berlin C. M., Jr., Effect of honey, dextromethorphan, and no treatment on nocturnal cough and sleep quality for coughing children and their parents. Archives of Pediatrics and Adolescent Medicine, 2007; 161, s. 1140–1146.
28. Płażek A., Badanie możliwości zwiększenia żywotności i stopnia zapylenia kwiatów gryki zwyczajnej w celu uzyskania wyższego plonu nasion, Streszczenie raportu rocznego z realizacji projektu MRiRWHORhn – 801 – PB – 5/16 zadanie nr 37, Katedra Fizjologii Roślin, Wydział Rolniczo-Ekonomiczny UR w Krakowie.
29. Popović V, Sikora V, Berenji J, Filipović V, Dolijanović Ž, Ikanović J, Dončić D. 2014 Analysis of buckwheat production in the world and Serbia. Agric. Econ. 61, s. 53–62.
30. Škrabanja, V., Kreft, I., Germ, M., Screening of common buckwheat genetic resources for recessive genes. In Buckwheat Germplasm in the World; (2018)Zhou, M., Kreft, I., Suvorova, G., Tang, Y.,Woo, S.H., Eds.; Academic Press, An Imprint of Elsevier: London, UK; s. 127–143
31. Wilczyńska, A., Phenolic content and antioxidant activity of different types of polish honey: A short report. Polish Journal of Food and Nutrition Sciences, 2010, 60(4), s. 309–313.
32. Woo S.H., Ohmoto T., Campbell C., Adachi T., Jong S.K.. Pre- and post-fertilization to backcrossing in interspecific hybridization between Fagopyrum esculentum and F. homotropicum with F. esculentum,2001, The proceeding of the 8th, s. 450-455.
33. Wyłupek T., Powroźnik M., Widelska M., Album roślin miododajnych, Wojewódzki Inspektorat Ochrony Roślin i Nasiennictwa w Lublinie, Lubin 2020, s. 46-47.
1 Reakcja Fentona polega na katalizowanym rozkładzie nadtlenku wodoru do rodników hydroksylowych (silnych utleniaczy) w obecności jonów wybranych metali.



