Rozdział 2
O miodzie słów kilka
Skład, barwa, aromat i smak miodu jest zróżnicowany i zależy głównie od różnorodności pożytków pszczelich, a także od regionu geograficznego, rasy pszczół oraz od czynników atmosferycznych oraz od konfekcjonowania i przechowywania miodu [Escuredo i in. 2014; Tornuk i in. 2013]. Miód to przede wszystkim przesycony roztwór cukrów prostych, który bardzo łatwo i szybko ulega krystalizacji. W znacznie mniejszej ilości, w miodzie, występują białka (enzymy), kwasy organiczne, witaminy (z grupy B i witamina C), minerały (w tym wapń, miedź, żelazo, magnez, mangan, fosfor, potas, sód i cynk), barwniki, związki lotne i inne substancje, niekiedy charakterystyczne tylko dla konkretnej odmiany miodu [Alqarni i in. 2012; Ciulu i in. 2011; Alvarez-Suarez i in 2013]. Miód jest bogaty we flawonoidy i kwasy fenolowe – związki aktywne biologicznie, działające jako naturalne przeciwutleniacze [Alqarni i in. 2012]. Uśredniony skład chemiczny miodu przedstawia Tabela 1.

Glukoza i fruktoza – najważniejsze cukry w miodzie
W miodach nektarowych fruktoza i glukoza stanowią zdecydowaną większość ogólnego składu. Średnio miody zawierają ok. 82% węglowodanów [Viteri i in. 2021]. Cukry w miodzie odpowiadają przede wszystkim za jego wysoką wartość energetyczną, a także lepkość, higroskopijność i zdolność do krystalizacji [Kamal i Klein 2011]. Profil cukrowy miodu zależy głównie od pochodzenia botanicznego, geograficznego oraz warunków pogodowych [Escuredo i in. 2014; Tornuk i in. 2013]. Stężenie fruktozy i glukozy, a także stosunek między nimi, są użytecznymi wskaźnikami do klasyfikacji miodów odmianowych. Wzajemna relacja glukozy i fruktozy decyduje o szybkości krystalizacji miodu. Z tego względu stosunek fruktozy do glukozy (F/G) przyjmuje się jako wskaźnik szybkości krystalizacji [Krauze 1991]. W większości dostępnych gatunków i odmian miodów fruktoza jest węglowodanem występującym w przewadze, z wyjątkiem takich miodów jak rzepakowy (Brassica napus) i z mniszka lekarskiego (Taraxacum officinale), gdzie zawartość glukozy jest wyższa niż fruktozy [Escuredo i in. 2014], w konsekwencji czego miody te na ogół charakteryzują się szybką krystalizacją. W miodach rzepakowych przeważa glukoza, dlatego też stosunek F/G jest niższy od 1.0, natomiast wartości F/G dla miodów akacjowych (Robinia pseudoacacia) wynosi powyżej 1.0, ze względu na wyższą zawartość fruktozy, dlatego przez długi czas miody te pozostają płynne. Profil cukrowy miodu jest badany przez naukowców na całym świecie. W tych profilach wykryto wiele innych węglowodanów: sacharoza, ramnoza, trehaloza, nigerobioza, izomaltoza, maltoza, maltotetraoza, maltotrioza, maltuloza, melezitoza, melibioza, nigeroza, palatynoza, rafinoza, erloza i inne [Fuente i in. 2011].
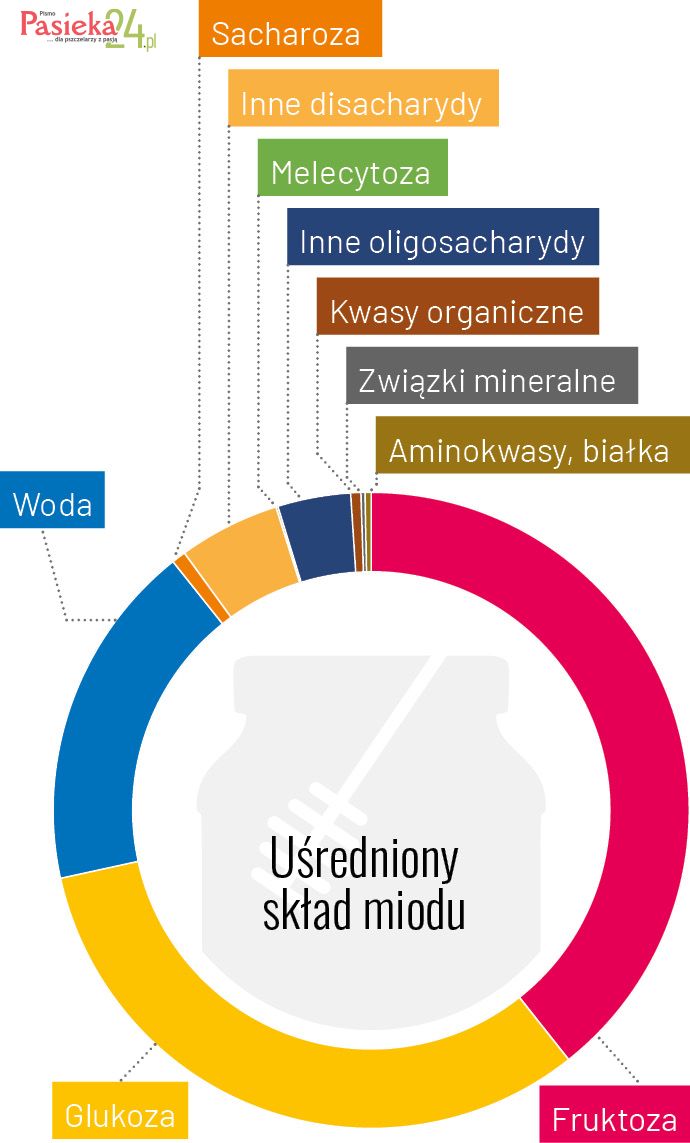
Składniki miodu |
[g/100g] |
Fruktoza |
38,2 |
Glukoza |
31,3 |
Woda |
17,2 |
Sacharoza |
0,7 |
Inne disacharydy |
5,0 |
Melecytoza |
<0,1 |
Inne oligosacharydy |
3,6 |
Kwasy organiczne |
0,5 |
Związki mineralne |
0,2 |
Aminokwasy, białka |
0,3 |
Smak miodu zależy od kwasów
Miody zawierają ok. 0,57% kwasów organicznych [Karabagias i in. 2014], które wpływają na smak, a częściowo odpowiadają za stabilność wobec mikroorganizmów i wspomagają działanie przeciwbakteryjne miodu. W zależności od pochodzenia botanicznego i geograficznego, w miodach zostały zidentyfikowane takie kwasy jak: asparaginowy, masłowy, cytrynowy, octowy, fumarowy, galakturonowy, mrówkowy, glukonowy, glutaminowy, glutarowy, glioksalowy, 2-hydroksymasłowy, α-hydroksyglutarowy, izocytrynowy, α-ketoglutarowy, mlekowy, jabłkowy, malonowy, metylomalonowy, 2-oksopentanowy, propionowy, pirogronowy, chinowy, szikimowy, bursztynowy, winowy, szczawiowy i inne [Mato i in. 2006]. Dominującym kwasem w miodzie jest kwas glukonowy, który jest produktem utleniania glukozy przez oksydazę glukozową, którą pszczoły miodne dostarczają podczas procesu zagęszczania nektaru [Karabagias i in. 2014]. Kwasy organiczne przyczyniają się do kwaśnego, charakterystycznego dla miodu pH (3,2-4,5) [French i in. 2005].
Miód pełen tablicy Mendelejewa
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Zawartość pierwiastków śladowych w miodzie zależy od rodzaju gleby, na której rosną rośliny miododajne [Escuredo i in. 2013; Madejczyk i Baralkiewicz 2008] i może wskazywać na botaniczne pochodzenie określonego miodu [Alqarni i in. 2012]. Potas jest pierwiastkiem występującym w największej ilości, odpowiadającym na ogół jednej trzeciej całkowitej zawartość minerałów w miodzie [Yücel i Sultanogl 2013]. Udowodniono, że pszczoły działają jako biofiltry metali toksycznych i zapobiegają zanieczyszczeniu patoki. Badania transferu metali toksycznych od pszczół robotnic do miodu w odniesieniu do stanu ekologicznego środowiska przeprowadzone przez Dżugan i in. [2018] wykazały, że stężenia większości badanych pierwiastków, z wyjątkiem Al (glinu) i Pb (ołowiu), były istotnie wyższe w ciałach pszczół niż w próbkach miodu, co wskazuje na protekcyjne działanie pszczół jako biofiltrów metali toksycznych dla wyprodukowanego miodu.
Witaminy w miodzie a pyłek kwiatowy
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Związki bioaktywne w miodzie

W roślinach występują związki polifenolowe o dużej różnorodności strukturalnej i złożoności. Pszczoły zbierając nektar, przenoszą te bioaktywne związki z rośliny do miodu [Silici i in. 2010]. Kwasy fenolowe i flawonoidy wykazują silne działanie przeciwutleniające, jak również bakteriobójcze, przeciwzapalne, przeciwalergiczne, przeciwzakrzepowe i przeciwnowotworowe [Cornara i in. 2017]. Dodatkowo aktywność antyoksydacyjną w miodzie potęgują: witamina C, witamina E, enzymy (m.in. katalaza, peroksydaza) oraz niektóre pierwiastki śladowe [Gheldof i in. 2002]. Wyniki badań potwierdziły obecność 30–150 różnych polifenoli w miodzie [Carlos i in. 2011; Khalil i in. 2011; Tsiapara i in. 2009]. Całkowita zawartość polifenoli według różnych badań wynosi 50-850 mg/kg, natomiast zawartość flawonoidów 36–150 mg/kg [Islam i in. 2012; Alzahrani i in. 2012; Khalil i in. 2012]. Obecność i stężenie tych bioaktywnych związków w miodach może się różnić w zależności od pochodzenia roślinnego oraz warunków geograficznych i klimatycznych. Niektóre związki bioaktywne, takie jak galangina, kempferol, kwercetyna, izoramnetyna i luteolina, są obecne we wszystkich rodzajach miodu, podczas gdy inne, takie jak hesperetyna i naringenina, występują tylko w określonych odmianach [Petrus i in. 2011]. W profilu związków fenolowych w miodach wykryto również: kwas wanilinowy, kawowy, syringowy, þ-kumarowy, ferulowy, kwercetyne, kempferol, mirycetyne, pinobanksyne, kwas elagowy, galangine, kwas 3-hydroksybenzoesowy, kwas chlorogenowy, kwas 4-hydroksybenzoesowy, kwas rozmarynowy, kwas galusowy, hesperetynę, kwas benzoesowy i inne [Alvarez-Suarez i in. 2012]. Dowiedziono, że zawartość polifenoli jest istotnie skorelowana z barwą miodu – ciemne wykazują wyższą zawartość związków fenolowych, które wpływają na wzmożoną aktywność antyoksydacyjną [Wesołowska i Dżugan 2017]. Ze względu na aktywność przeciwutleniającą i różnorodność występowania związków antyoksydacyjnych w miodach, parametr ten może być praktyczną wskazówką do określania pochodzenia botanicznego miodu [Dżugan i in. 2018].
Kompozycja zapachowa miodu
Aromat miodu wytwarzany jest przez złożone mieszanki związków lotnych, które mogą się różnić w zależności od nektaru, warunków przetwarzania i przechowywania. Miody odmianowe mają charakterystyczny zapach kwiatów roślin, ze względu na obecność lotnych związków w nektarze [Castro-Vázquez i in. 2007]. We frakcji lotnej miodu zidentyfikowano ponad 600 różnych związków, które nadają miodom właściwości aromatycznych i przyczyniają się do jego potencjalnej aktywności biomedycznej [Manyi-Loh i in. 2011]. Niektóre związki zapachowe są używane jako markery miodów odmianowych, np. charakterystyczne są diketony, związki siarki i alkany dla miodu eukaliptusowego, podczas gdy heksanal i heptanal są głównymi związkami w aromacie miodu lawendowego [Castro-Vazquez i in. 2007; Radovic i in. 2001].
Czynniki, które mają wpływ na zmianę składu miodu
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Miód na zdrowie
Miód przede wszystkim jest produktem wysokokalorycznym, ponieważ 100 g miodu dostarcza ok. 300 kcal, a dzienna porcja (20 g miodu) pokrywa ok. 3% zalecanego dziennego spożycia (ang. recommended daily intake, RDI) [Bogdanov i in. 2008]. Wartość odżywcza miodu wynika z jego złożonego składu chemicznego. Bioaktywne właściwości miodu są związane z pochodzeniem botanicznym i geograficznym roślin, z których pszczoły zbierają nektar [Oroian i in. 2015]. Tradycyjna wiedza o korzystnych właściwościach zdrowotnych miodu i współczesna nauka dały początek apiterapii, która oznacza medyczne zastosowanie miodu i produktów pszczelich. Apiterapia stała się głównym przedmiotem badań z zakresu medycyny alternatywnej, ponieważ w wielu dobrze znanych metodach profilaktyki medycyny ludowej, miód jest stosowany w leczeniu wszelkich dolegliwości, a właściwości terapeutyczne miodu są coraz częściej dokumentowane we współczesnej literaturze naukowej. Badania z ostatnich dwóch dekad pozwoliły poznać miód jako nutraceutyk, który ma działanie ochronne na żołądek, wykazuje właściwości hepatoprotekcjne, zmniejszające objawy przy hipoglikemii. Ponadto działa przeciwutleniająco, przeciwnadciśnieniowo, przeciwbakteryjnie, przeciwgrzybicznie, przeciwzapalnie, immunomodulująco, przyspieszająco na gojące się rany, kardioochronnie i antynowotworo [Manyi-Loh i in. 2011; Cantarelli i in. 2008]. Sprawdzano także skuteczność miodów w leczeniu artretyzmu [Kocyigit i in. 2019], raka piersi i szyjki macicy [Fauzi i in. 2019], raka okrężnicy [Afrin i in. 2017] oraz glejaka wielopostaciowego [Moskwa i in. 2014]. Dowiedziono również zmniejszenie ryzyka wystąpienia Helicobacter pylori dzięki stosowaniu miodu [Boyanova i in. 2015]. Miód i jego składniki mogą łagodzić stres oksydacyjny i skutki z nim związane. Neuroprotekcyjne działanie miodu przynosi korzystne efekty przy neurodegeneracji we wczesnych etapach stosowania w trakcie leczenia [Mijanur i in. 2014]. Zainteresowanie na temat biologicznych właściwości miodu sprawdza się przy użyciu badań in vitro, liniach komórkowych oraz na modelach zwierzęcych, ale także przy wykorzystaniu badań epidemiologicznych oraz interwencyjnych pacjentów.

Literatura
1. Afrin S.; Forbes-Hernandez T.Y.; Gasparrini M.; Bompadre S.; Quiles J.L.; Sanna G.; Spano N.; Giampieri F.;Battino M. (2017) Strawberry-tree honey induces growth inhibition of human colon cancer cells and increases ROS generation: A comparison with Manuka honey. Int. J. Mol., 18, 613.
2. Alqarni A. S., Owayss A. A., Mahmoud A. A. (2012). Mineral content and physical properties of local and imported honeys in Saudi Arabia. Journal of Saudi Chemical Society, 5, 618 - 625.
3. Alvarez-Suarez J.M.; Giampieri F.; González-Paramás A.M.; Damiani E.; Astolfi P.; Martinez-Sanchez G.; Bompadre S.; Quiles J.L.; Santos- Buelga C.; Battino M. (2012). Phenolics from monofloral honeys protect human erythrocyte membranes against oxidative damage. Food Chem. Toxicol., 50, 1508-1516.
4. Barra, M. P. G., Ponce-Díaz, M. C., & Venegas-Gallegos, C. (2010). Volatile compounds in honey produced in the central valley of Ñuble Province, Chile. Chilean Journal of Agricultural Research, 70, 75-84.
5. Bogdanov S., Jurendic T., Sieber R., Gallmann P. (2008). Honey for nutrition and health: a review. Journal of the American College of Nutrition, vol. 27, no. 6, 677–689.
6. Bogdanov, S. (2016). Honey Composition. Bee Product Science: https://www.researchgate. net/publication/304011775_Honey_Composition
7. Bonté F., Desmoulière A. (2013). Le miel: origine et composition. Actualités pharmaceutiques, 531, 18-21.
8. Boyanova L., Ilieva J., Gergova G., Vladimirov B., Nikolov R., Mitov, I. (2015). Honey and green/black tea consumption may reduce the risk of Helicobacter pylori infection. Diagnostic microbiology and infectious disease, 82(1), 85–86.
9. Cantarelli M. A., Pellerano R. G., Marchevsky E. J., Camiña J. M., “Quality of honey from Argentina: study of chemical composition and trace elements,” Journal of the Argentine Chemical Society, vol. 96, no. 2, pp. 33–41, 2008
10. Carlos A. U., David H., Carmen G. (2011). Role of honey polyphenols in health, Journal of ApiProduct and ApiMedical Science, vol. 3, no. 4, pp. 141–159.
11. Castro-Vázquez L., Díaz-Maroto M. C., Pérez-Coello M. S. (2007). Aroma composition and new chemical markers of Spanish citrus honeys. Food Chemistry, 103, 601–606.
12. Chernetsova E. S., Morlock G. E. (2012). Assessing the capabilities of direct analysis in real time mass spectrometry for 5-hydroxymethylfurfural quantitation in honey. International Journal of Mass Spectrometry, 314, 22–32.
13. Ciulu M., Solinas S., Floris I., Panzanellia A., Pilo M. I., Piu P. C. (2011). RPHPLC determination of water-soluble vitamins in honey. Talanta, 83, 924–929.
14. Cornara L., Biagi M., Xiao J., Burlando B. (2017). Therapeutic Properties of Bioactive Compounds from Different Honeybee Products. Front. Pharmacol. 8:412.
15. Dżugan M., Wesołowska M., Zaguła G., Kaczmarski M., Czernicka M., Puchalski C. (2018). Honeybees (Apis mellifera) as a biological barrier for contamination of honey by environmental toxic metals. Environ Monit Assess 190, 101.
16. Dżugan M.; Tomczyk M.; Sowa P.; Grabek-Lejko D. (2018). Antioxidant Activity as Biomarker of Honey Variety. Molecules, 23, 2069.
17. Escuredo O., Dobre I., Fernández-González M., Seijo M. C. (2014). Contribution of botanical origin and sugar composition of honeys on the crystallization phenomenon. Food Chemistry, 149, 84-90.
18. Fauzi A.N.; Norazmi M.N.; Yaacob N.S. (2019). Tualang honey induces apoptosis and disrupts the mitochondrial membrane potential of human breast and cervical cancer cell lines. Food Chem. Toxicol. 49, 871–878.
19. French V. M., Cooper R. A., Molan P. C. (2005). The antibacterial activity of honey against coagulase-negative staphylococci, Journal of Antimicrobial Chemotherapy, 56, no. 1, 228–231.
20. Fuente, E., Ruiz-Matute, A. I., Valencia-Barrera, R. M., Sanz, J., Castro, I. M. (2011). Carbohydrate composition of Spanish unifloral honeys. Food Chemistry, 129, 1483-1489.
21. Gheldof N.; Engeseth N.J. (2002). Antioxidant capacity of honeys from various floral sources based on the determination of oxygen radical absorbance capacity and inhibition of in vitro lipoprotein oxidation in human serum samples. J. Agric. Food Chem., 50, 3050-55.
22. Islam A., Khalil M. I., Islam M. N. (2012). Physicochemical and antioxidant properties of Bangladeshi honeys stored for more than one year, BMC Complementary and Alternative Medicine, vol. 12, article 177.
23. Kamal M. A., Klein P. (2011). Determination of sugars in honey by liquid chromatography. Saudi Journal of Biological Sciences, 18, 17-21.
24. Karabagias I. K., Badeka A., Kontakos S., Karabournioti S., Kontominas M. G. (2014). Characterisation and classification of Greek pine honeys according to their geographical origin based on volatiles, physicochemical parameters and chemometrics. Food Chemistry, 146, 548–557.
25. Kocyigit A.; Guler E.M.; Kaleli S. (2019). Anti-inflammatory and antioxidative properties of honey bee venom on Freund’s Complete Adjuvant-induced arthritis model in rats. Toxicon., 161, 4–11.
26. Krauze A. (1991). Sugar spectrum of polish nectar and honeydew honeys, Acta Alimentaria Polonica,nXVII/XLI, s. 111.
27. Madejczyk M., Baralkiewicz D. (2008) Characterization of Polish rape and honeydew honey according to their mineral contents using ICP-MS and F-AAS/AES. Analytica Chimica Acta, 617, 11–17.
28. Manyi-Loh C. E., Ndip R. N., Clarke A. M., (2011) .Volatile compounds in honey: a review on their involvement in aroma, botanical origin determination and potential biomedical activities, International Journal of Molecular Sciences, vol. 12, no. 12, pp. 9514–9532.
29. Mato, I. S., Huidobro, J. F., Simal-Lozano, J. S., Sancho, M. T. (2006). Rapid determination of nonaromatic organic acids in honey by capillary zone electrophoresis with direct ultraviolet detection. Journal of Agricultural and Food Chemistry, 54, 1541-1550.
30. Mijanur M. R., Siew H.G., Md. Ibrahim K. (2014). Neurological Effects of Honey: Current and Future Prospects, Evidence-Based Complementary and Alternative Medicine, vol. 2014, Article ID 958721.
31. Moreira, R. F. A., Maria, C. A. B., Pietroluongo, M., Trugo, L. C. (2010). Chemical changes in the volatile fractions of Brazilian honeys during storage under tropical conditions. Food Chemistry, 121, 697–704.
32. Moskwa J.; Borawska M.H.; Markiewicz-Zukowska R.; Puscion-Jakubik A.; Naliwajko S.K.; Socha K.; Soroczynska J. (2014). Polish natural bee honeys are anti-proliferative and anti-metastatic agents in human glioblastoma multiforme U87MG cell line. PLoS ONE, 9, e90533.
33. Oroian M.; Amariei S.; Leahu A.; Gut G. (2015). Multi-Element Composition of Honey as a Suitable Tool for Its Authenticity Analysis. Polish J. Food Nutr. Sci., 65, 93–100.
34. Petrus K., Schwartz H., Sontag G. (2011). Analysis of flavonoids in honey by HPLC coupled with coulometric electrode array detection and electrospray ionization mass spectrometry, Analytical and Bioanalytical Chemistry, vol. 400, no. 8; 2555–2563.
35. Radovic B. S., Careri M., Mangia A., Musci M., Gerboles M., Anklam, E. (2001). Contribution of dynamic headspace GC–MS analysis of aroma compounds to authenticity testing of honey. Food Chemistry, 72, 511–520.
36. Silici S., Sagdic O., Ekici L. (2010). Total phenolic content, antiradical, antioxidant and antimicrobial activities of Rhododendron honeys Food Chemistry;121(1):238-243.
37. Tornuk F., Karaman S., Ozturk I., Toker, O. S., Tastemur B., Sagdic O., Dogan M., Kayacier A. (2013). Quality characterization of artisanal and retail Turkish blossom honeys: determination of physicochemical, microbiological, bioactive properties and aroma profile. Industrial Crops and Products, 46, 124 – 131.
38. Tsiapara A.V., Jaakkola M., Chinou I., i in. (2009). Bioactivity of Greek honey extracts on breast cancer (MCF-7), prostate cancer (PC-3) and endometrial cancer (Ishikawa) cells: profile analysis of extracts. Food Chem 116, 702–708.
39. Viteri R., Zacconi F., Montenegro G., Giordano A. (2021). Bioactive compounds in Apis mellifera monofloral honeys. Journal of food science, 86(5), 1552–1582.
40. Wesołowska M., Dżugan M.,(2017). The use of Photochem device in evaluation of antioxidant activity of polish honey. Food Anal. Method., 10, 1568–1574.
41. Yücel Y., Sultanoglu P. (2013). Characterization of honeys from Hatay region by their physicochemical properties combined with chemometrics. Food Bioscience I, 1, 16–25.
1 ppm (ang. parts per million) – liczba części na milion, oznaczenie stosowane m.in. przy wyrażaniu stężeń, gdzie się określa, ile cząsteczek związku chemicznego przypada na 1 milion cząsteczek roztworu.



