Miody spadziowe
Miód ze spadzi iglastej pod lupą
Miód spadziowy charakteryzuje się wyższymi wartościami przewodności elektrycznej, pH, kwasowości i zawiera więcej popiołu niż miody nektarowe. Odznacza się także brązową, prawie czarną barwą, bardzo często z zielonkawym odcieniem. W składzie miodu spadziowego jest więcej oligosacharydów, ale mniej cukrów prostych niż w gatunkowych miodach nektarowych dostępnych na rynku. Uważa się również, że wykazuje silniejsze właściwości przeciwutleniające i antybakteryjne niż większości miodów, których źródłem jest nektar.

Według Rozporządzenia Ministra Rolnictwa i Rozwoju Wsi z dnia 3 października 2003 r. w sprawie szczegółowych wymagań w zakresie jakości handlowej miodu [Dz.U. 2003 nr 181 poz. 1773] rozróżniamy dwie odmiany miodów spadziowych: miód ze spadzi liściastej oraz miód ze spadzi iglastej. Polski miód spadziowy iglasty produkowany jest głównie z wydzielin lub wydalin owadów z rzędu pluskwiaków (głównie mszyc), żerujących na jodle pospolitej (Abies alba), a także świerku pospolitym (Picea abies), rzadziej na sośnie zwyczajnej (Pinus sylvestris L.). Spadź pojawia się także na modrzewiach europejskich (Larix decidua L.), ale obecność w ulu pożytku z tego jedynego w Polsce drzewa iglastego, które gubi na zimę igły, jest dla pszczelarzy bardzo problematyczna. Miód ze spadzi modrzewiowej nosi nazwę „cementowego”, ponieważ bardzo szybko krystalizuje już w plastrach w zbitą, twardą masę, trudną do usunięcia czy odwirowania. A pozostawienie takiego pożytku rodzinie pszczelej na okres zimowli (miód „cementowy” pojawia się zwykle dość późno, na początku września) jest niemalże jednoznaczne ze śmiercią głodową. Dekrystalizacja miodu „cementowego” jest bardzo trudna, nawet w wyższej temperaturze niż dopuszczalna (42°C). Barwa krupca jest nietypowa, brązowa z brudnoszarym odcieniem. W smaku jest zdecydowanie mniej słodki w porównaniu z miodami ze spadzi iglastej pozyskanej ze świerków, sosen czy jodeł.
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Charakterystyka pożytku

Pozyskiwanym przez pszczoły surowcem do wytworzenia miodu nektarowego jest nektar z kwiatów roślin miododajnych, natomiast w miodach spadziowych tym surowcem są wydaliny owadów wysysających żywe części roślin lub wydzieliny żywych części roślin – spadzi [Dyrektywa Rady 2001/110/WE; Dz.U. 2015 poz. 850].
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów

Miód ze spadzi iglastej – jodła pospolita
Jodła pospolita (Abies alba) występuje głównie w południowej i południowo-wschodniej Polsce. Podkarpacie i Góry Świętokrzyskie to największe siedliska starodrzewu jodły. Są to jedyne w swoim rodzaju obszary porośnięte borami jodłowymi [Tworek 1998; Witkowska-Żuk 2008]. Raz na kilka lat, gdy warunki pogodowe sprzyjają mszycom, jodła pospolita staje się bogatym źródłem miodu spadziowego. Najważniejszym gatunkiem mszyc żerujących na jodłach pospolitych jest Cinara pectinatae (Nördl.), Cinara confinis (Koch) oraz Cinara piceae (Panzer) z rodziny Lachnidae [Durak i in. 2011]. Mszyce Cinara pectinatae przy sprzyjających warunkach pogodowych żerują masowo na jodłach pospolitych w lipcu i sierpniu, często także we wrześniu.
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Miód spadziowy czy nektarowy?

Jednoznaczne rozróżnienie miodów nektarowych i spadziowych jest odpowiedzią na aktualne potrzeby konsumentów. W zależności od trwających trendów na rynku spożywczym, w wielu krajach miód nektarowy jest bardziej ceniony niż miód spadziowy, a w innych preferencje są zupełnie przeciwstawne. Aby poprawnie zdefiniować rodzaj miodu, należy oprzeć się na wynikach kilku analiz laboratoryjnych, które łącznie mogą dać gwarancję prawidłowej oceny przynależności gatunkowej miodu.
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
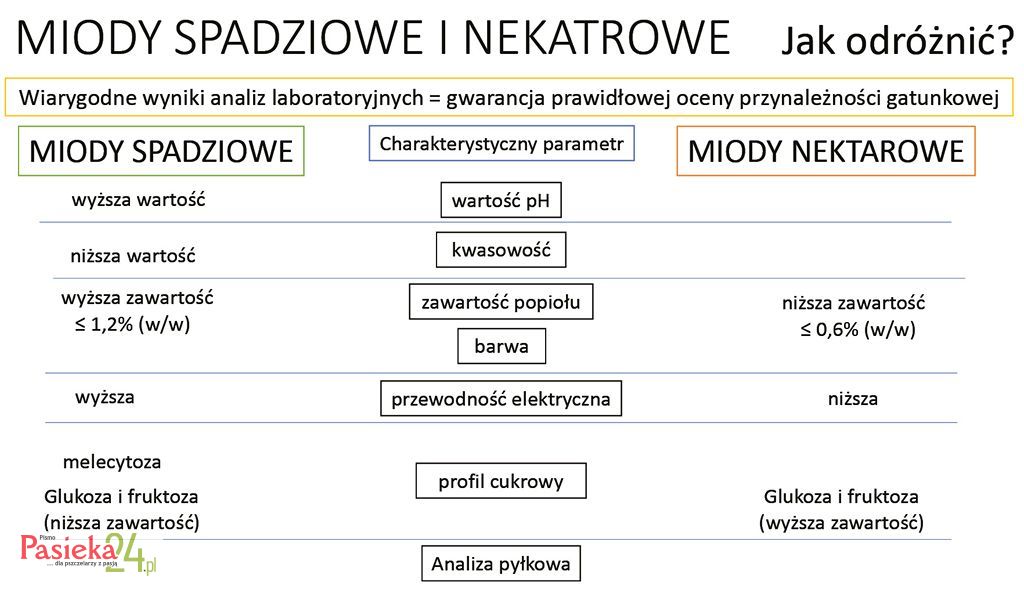
Dodatkowo miody spadziowe mają wyższą zawartość popiołu niż miody nektarowe [Diez i in. 2004]. Ogólnie zawartość popiołu w miodach nektarowych wynosi ≤ 0,6% (ww.); a w spadziowych lub mieszankach miodów spadziowo-nektarowych wynosi ≤ 1,2% (ww.) [Ouchemoukh i in. 2007].
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
MIÓD ZE SPADZI IGLASTEJ
Cechy organoleptyczne
W stanie płynnym miód ze spadzi iglastej przypomina w strukturze gęstą ciecz. Odróżnia się ciemnobrunatną barwą z szarozielonkawym odcieniem, który w zależności od pozostałych składników może przybierać również odcień brązowy do prawie czarnego. Po krystalizacji barwa miodu ze spadzi iglastej jest jaśniejsza, wg Polskiej Normy powinna być ciemnobrązowa z odcieniem szarym lub zielonkawym. Miód ze spadzi iglastej na ogół wolno krystalizuje (najczęściej po upływie piątego do ósmego tygodnia), przybierając formę średnioziarnistą, a kryształy mogą tworzyć zlepy. Przechowywany przez dłuższy okres w temperaturze ok. 20°C często rozwarstwia się na dwie części, górną płynną i dolną skrystalizowaną. Smak określa się jako słodki, łagodny, z przyjemnym, lekko żywicznym lub korzennym aromatem.
Skład chemiczny

W miodach ze spadzi iglastej, oprócz podstawowych cukrów prostych (czyli fruktozy, glukozy i sacharozy) zidentyfikowano również takie cukry jak: maltoza, turanoza, trehaloza oraz izomaltoza. Średnia suma wszystkich oznaczonych disacharydów w miodach ze spadzi iglastej, wg badań Rybak-Chmielewskiej i in. [2013], wynosiła niecałe 9 g/100 g miodu, z czego najwięcej było maltozy – średnio 3,2 g/100 g, trehalozy –2,7 g/100 g, turanozy – 1,8 g/100 g oraz izomaltozy –1,2 g/100 g. Najbardziej charakterystycznym dla tego rodzaju miodu jest trisacharyd – melecytoza, znany także jako cukier modrzewiowy, który składa się z dwóch cząsteczek glukozy i jednej cząsteczki fruktozy. Nazwę tego trisdachardu zawdzięczamy Marcellinowi Pierremu Berthelotwi, francuskiemu chemikowi, który w 1859 r. odkrył w miodzie nowy cukier i nazwał go melecytozą, czyli cukrem modrzewiowym od nazwy drzewa (modrzew po francusku to mélèze), na którym wystąpiła spadź zbierana przez pszczoły [Haragsim 1970]. Wiele lat później stwierdzono, że duże ilości melecytozy są również w spadzi z innych drzew – lip, dębów, jodeł i świerków. Ten trisacharyd nie znajduje się w tkankach przewodzących roślin, ale powstaje przy udziale enzymów w przewodzie pokarmowym mszyc [Bacon i Dickinson 1957]. Według Haragsima [1970] bardzo szybko krystalizujący miód ze spadzi jest wynikiem intensywnego rozwoju i żerowania mszycy Cinara laricis Htg. Średnia zawartość tego cukru, według badań przeprowadzonych przez Zakład Pszczelnictwa w Puławach, dla miodów spadziowych wynosi 3,2 g/100 g [Rybak-Chmielewska i in. 2013]. Dodatkowo jako biochemiczny marker miodu spadziowego zidentyfikowano związek lotny – diacylogliceryloeter z wykorzystaniem magnetycznego rezonansu jądrowego.
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Badania przeprowadzone przez Instytut Ogrodnictwa – Zakład Pszczelnictwa w Puławach już w 2003 r. wykazały, że miody pozyskane z pożytku spadziowego z modrzewi, w porównaniu z miodami spadziowymi z drzew typowo iglastych, charakteryzowały się ok. 10-krotnie wyższą zawartością melecytozy (23%) i zdecydowanie niższą zawartością cukrów prostych (średnio ok. 40%). Wysoką zawartość melecytozy w miodach pozyskanych ze spadzi pojawiającej się typowo na modrzewiach można uznać za przyczynę bardzo szybkiej krystalizacji. Z badań przeprowadzonych już w 1985 r. przez Imdorfa i jego współpracowników wynika, że do skrystalizowania melecytozy wystarczy stężenie tego cukru na poziomie 10–12% w przeliczeniu na suchą masę. Im wyższe stężenie melecytozy, tym szybciej postępuje krystalizacja. Po skrystalizowaniu konsystencja miodu jest bardzo twarda, stąd określenie „cement” lub „skała” dla tej szczególnej odmiany miodu spadziowego [Haragsim 1970]. Miód „cementowy” wykazywał także wyższą przewodność elektryczną (średnio 1,5 mS/cm) w porównaniu do miodów spadziowych pozyskanych głównie ze spadzi występującej na jodle pospolitej (średnio 0,95 mS/cm).
Wymagania jakościowe
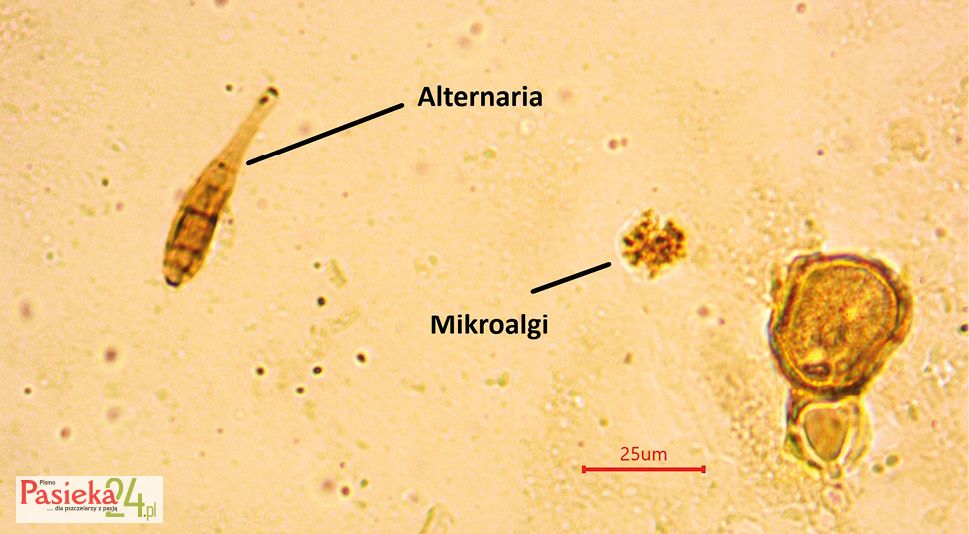
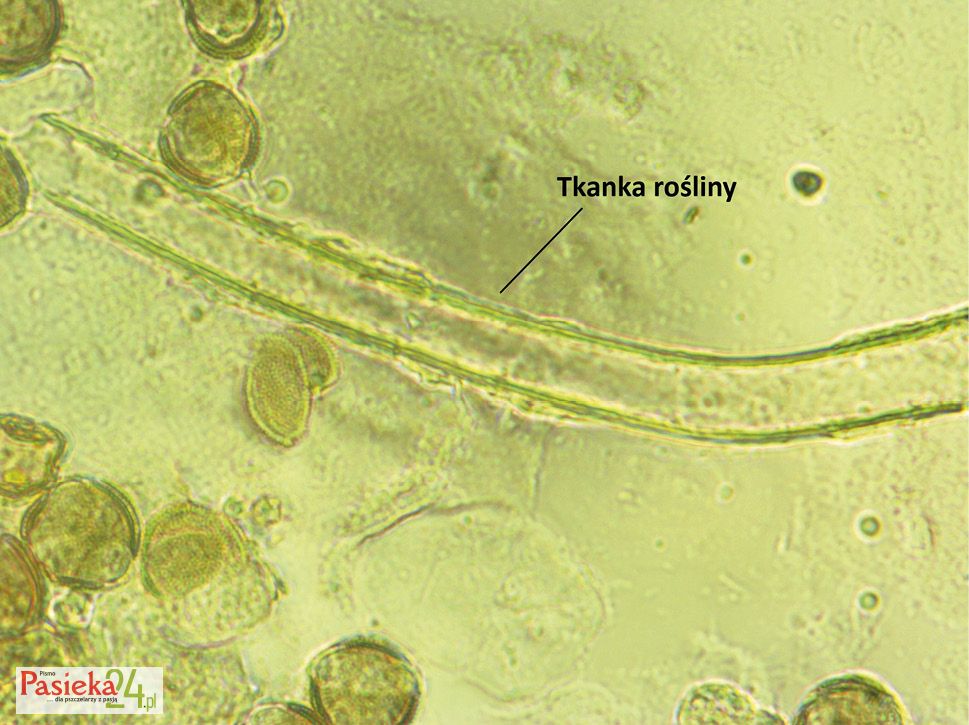
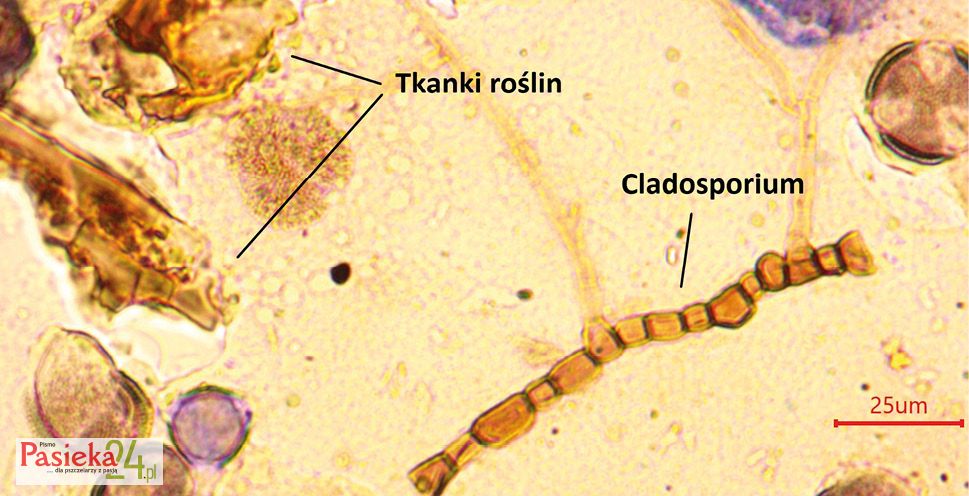
Wymagania jakościowe dla miodów spadziowych określa Dyrektywa Parlamentu Europejskiego i Rady 2014/63/UE z dnia 15 maja 2014 r. zmieniająca dyrektywę Rady 2001/110/WE oraz na jej podstawie uchwalone Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 3 października 2003 r. w sprawie szczegółowych wymagań w zakresie jakości handlowej miodu [Dz.U. 2003.181.1773] z późniejszymi zmianami [Dz.U. 2015 poz. 850], którego wejście w życie uchyliło Polską Normę – Miód pszczeli (PN-88/A-77626). Dla miodów spadziowych nie określa się procentowego udziału pyłku przewodniego (głównego), ponieważ surowcem jest spadź, a nie nektar roślin miododajnych zawierający pyłek kwiatowy, na podstawie którego ocenia się odmianowość miodów nektarowych. Natomiast porównanie osadu miodowego1 prób miodów nektarowych i spadziowych powinien być potwierdzeniem rozróżnienia tych dwóch rodzajów miodów. Obraz mikroskopowy dla miodów ze spadzi zawiera zdecydowanie mniej ziaren pyłków roślin owadopylnych, a więcej struktur i tkanek roślin, mikroalg, zarodników grzybów pleśniowych oraz ziarna pyłków roślin wiatropylnych, które przemieszczając się wraz z wiatrem, przyczepiają się do lepkiej wydzieliny mszyc.
 [...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
[...] - część treści ukryta, w całości dostępna tylko dla zalogowanych e-Prenumeratorów
Obrazy mikroskopowe osadu miodu spadziowego
Wyniki analizy mikroskopowej próbek miodów spadziowych mogą być pomocne w ostatecznej ocenie gatunkowej badanego miodu. Charakterystyczne elementy znajdujące się w osadzie miodowym ze spadzi z drzew iglastych to np. mikroalgi – zwykle gatunki zielenic (Chlorophyceae) oraz zarodniki grzybów pleśniowych (np. z rodzaju Alternaria bądź Cladosporium).
_foto_dodatkowe_milan_motyka.jpg)
Właściwości zdrowotne
Stosowanie miodu spadziowego w celach leczniczych wykorzystuje się już od wielu lat, ze względu na przypisywany szeroki zakres działań terapeutycznych, takich jak właściwości przeciwbakteryjne i przeciwzapalne. Miód spadziowy stosowany jest w stymulacji gojenia się ran i oparzeń skóry, także podczas leczenia wrzodów żołądka, zapalenia żołądka oraz niegojących się owrzodzeń kończyn dolnych [McLoone i in. 2016; Gheldof i Engeseth 2002; Mayer i in. 2014]. Ponadto miód spadziowy zawiera znacznie więcej oligosacharydów niż miód nektarowy [Prodolliet i Hischenhuber 1998]. Oligosacharydy miodowe wykazują potencjalną aktywność prebiotyczną, zwiększając populacje bifidobakterii (Bifidobacterium) i pałeczek kwasu mlekowego (Lactobacillus) w jelicie ludzkim, co przyczynia się do wzbogacenia mikroflory jelitowej [Sanz i in. 2005]. Wyższe zawartości składników mineralnych, w tym ponaddwudziestokrotnie wyższe stężenie potasu, dziesięciokrotnie manganu oraz trzykrotnie magnezu w stosunku do popularnego miodu rzepakowego [Madejczyk i Baralkiewicz 2008] utwierdza w przekonaniu o bogactwie mineralnym miodu spadziowego, który już w niewielkich ilościach może służyć jako naturalny sposób na uzupełnienie niedoborów niektórych mikroelementów w diecie.

Literatura
1. Bacon J.S.D., Dickinson B. (1957) - The origin of melezitose: a biochemical relationschip between the lime tree (Tilia spp.) and Aphis (Eucallipterus tiliae L.) Biochm. J. 66; s. 289-299.
2. Bogdanov, S., Baumann, E. (1988). Determination of sugar composition of honeys by HPLC. Mitteilungen aus dem Gebiete der Lebensmitteluntersuchung und Hygiene, 79, s. 198–206.
3. Campos, G., della Modesta, R. C., da Silva, T. J. P., Raslan, D. S. (2001). Comparison of some components between floral honey and honeydew honey. Rivista do Instituto Adolfo Lutz, 60, s. 59–64.
4. Can Z., Yildiz O., Sahin H., Akyuz Turumtay E., Silici S., Kolayli S.; An investigation of Turkish honeys: Their physico-chemical properties, antioxidant capacities and phenolic profiles; Food Chemistry, 180 (2015), s. 133-141.
5. Diez, M. J., Andrés, C. Terrab, A. (2004). Physicochemical parameters and pollen analysis of Moroccan honeydew honeys. International Journal of Food Science & Technology 39(2), s. 167-176.
6. Durak R., Durak T., Borowiak-Sobkowiak B.; Charakterystyka mszyc (Hemiptera: Aphidoidea) z zastosowaniem funkcjonalnych grup ekologicznych na przykładzie lasów bukowych w Beskidach Wschodnich; Wiadomości Entomologiczne; 2011; 30; 1.
7. Dyrektywa Rady 2001/110/WE z dnia 20 grudnia 2001 r. odnosząca się do miodu.
8. Escuredo O., Míguez M., Fernández-González M., Seijo M.C.; Nutritional value and antioxidant activity of honeys produced in a European Atlantic area; Food Chemistry, 138 (2–3) (2013), s. 851-856.
9. Fo¨ldha´zi, G. (1994). Analysis and quantitation of sugars in honey of different botanical origin using high performance liquid chromatography. Acta Alimentaria, 23, s. 299–311.
10. Gałuszka H., Ostrowska W., Kędracki T. (1987) - Gospodarka pasieczna w terenach spadziowych., PWRiL, Poznań, s. 116.
11. Garciá-Alvarez, M., Ceresuela, S., Huidobro, J. F., Hermida, M., Rodríguez-Otero, J. L. (2002). Determination of polarimetric parameters of honey by near-infrared transflectance spectroscopy. Journal of Agricultural and Food Chemistry 50(3),s, 419-425.
12. Gheldof, N.; Engeseth, N. (2002). Antioxidant capacity of honeys from various floral sources based on the determination of oxygen radical absorbance capacity and inhibition of in vitro lipoprotein oxidation in human serum samples. Journal of Agricultural and Food Chemistry; 50(10), s.3050-3055.
13. Haragsim (1970) - Spadź i pszczoły. PWRiL, Warszawa.
14. Imdorf A., Bogdanov S., Kilchenmann V. (1985) - Zementhonig im Honig- und Brutraum - was dann? I. Teil: Wie űberwintern Bienenvölker auf Zementhonig. Schweiz. Bienenztg. 108(10); s. 534-544.
15. Kirkwood, K. C., Mitchell, T. J., Smith, D. (1960). An examination of the occurrence of honeydew in honey. Analyst, 85, s. 412–416.
16. Krauze, A., Zalewski, R. (1991). Classification of honeys by principal component analysis on the basis of chemical and physical parameters. Zeitschrift fur Lebensmittel Untersuchung und Forschung A, 192, s. 19–23.
17. Madejczyk, M., Baralkiewicz, D. (2008). Characterization of Polish rape and honeydew honey according to their mineral contents using ICP-MS and F-AAS/AES. Analytica Chimica Acta, 617(1-2), s. 11–17.
18. Mayer A., Slezak V., Takac P., Olejnik J., Majtan J.; Treatment of non-healing leg ulcers with honeydew honey Journal of Tissue Viability, 23 (3) (2014), s. 94-97.
19. McLoone P., Warnock M., Fyfe L.; Honey: A realistic antimicrobial for disorders of the skin; Journal of Microbiology, Immunology and Infection, 49 (2016), s. 161-167.
20. Osés S.M., Pascual-Maté A., de la Fuente D., de Pablo A., Fernández-Muiño M.A., Sancho M.T.; Comparison of methods to determine antibacterial activity of honeys against Staphylococcus aureus; NJAS - Wageningen Journal of Life Sciences, 78 (2016), s. 29-33.
21. Ouchemoukh, S., Louaileche, H., Schweitzer, P. (2007). Physicochemical characteristics and pollen spectrum of some Algerian honeys. Food Control 18(1), 52-58.
22. Prodolliet, J., Hischenhuber, C. (1998). Food authentication by carbohydrate chromatography. Zeitschrift Für Lebensmitteluntersuchung Und-Forschung A 207(1), s. 1-12.
23. Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 29 maja 2015 r. zmieniające rozporządzenie w sprawie szczegółowych wymagań w zakresie jakości handlowej miodu Dz.U. 2015 poz. 850.
24. Rybak-Chmielewska H., Szczęsna T., Waś E., Jaśkiewicz K., Teper D.; Characteristics of Polish Unifloral Honeys IV. Honeydew Honey, Mainly Abies Alba L.; Journal of Apicultural Science, vol.57, no.1, 2013, s. 51-59.
25. Sanz, M., Polemis, N., Morales, V., Corzo, N., Drakoularakou, A., Gibson, G., Rastall, R.827 (2005). In vitro investigation into the potential prebiotic activity of honey oligosaccharides. 828 Journal of Agricultural and Food Chemistry 53(8), s. 2914-2921.
26. Szczęsna T., Rybak-Chmielewska H., Skubida P., Contribution to the understanding of the phenomenon of "cement" honey; Journal of Apicultural Science; 2003; Volume 47, Issue 2, s. 103-108.
27. Tworek K. (1998) - Spadź i jej wytwórcy., po red. J. Prabucki; Pszczelnictwo, Wydawnictwo Promocyjne “Albatros”, Szczecin, s. 863-879.
28. Weston, R. J., Brocklebank, L. K. (1999). The oligosaccharide composition of some New Zealand honeys. Food Chemistry, 64, s. 33–37.
29. White, J. W. (1980). Detection of honey adulteration by carbohydrate analysis. Journal of Association of the Official Analytical Chemistry, 63, s. 11–18.
30. Witkowska-Żuk L (2008) – Leśne zbiorowiska roślin, w: Flora Polski, Atlas Roślinności Polski, MULTICO, Oficyna Wydawnicza, Warszawa, s. 15-70.
1 Osad miodowy – osad powstały w wyniku odwirowania wodnego roztworu miodu, zawierający części stałe, nierozpuszczalne w wodzie.



