Stworzenie receptury oraz rekomendacji wdrożeniowych dla preparatu do zwalczania Varroa destructor o działaniu długookresowym na nośniku stałym, na bazie kwasów organicznych i porównanie go z innym tego typu preparatem stosowanym przez pszczelarzy na terenie Polski
Dr Beata Bąk, mgr Jakub Wilk, dr Maciej Siuda, prof. dr hab. Jerzy Wilde,
Katedra Drobiarstwa i Pszczelnictwa
Uniwersytet Warmińsko-Mazurski w Olsztynie
Ul. Słoneczna 410-710 Olsztyn
Projekt finansowany w ramach mechanizmu Wsparcie rynku produktów pszczelich” na rok pszczelarski 2021-2022” (Projekt-Wsparcie naukowo badawcze) w ramach umowy nr 3/B/703/2021/22
Wstęp
Warroza i metody jej leczenia
Warroza jest chorobą pszczoły miodnej wywoływaną przez roztocza Varroa destructor. Pasożyt ten wykazuje wysoce patogenne oddziaływanie na zainfekowane pszczoły i czerw kryty. Nie leczone rodziny pszczele czeka śmierć w ciągu 3-4 lat (Fries 1994). W celu ochrony pasiek przed silną inwazją V. destructor zaleca się regularne, coroczne zwalczanie pasożyta. Niewykonanie zabiegu przeciwwarrozowego w przypadku jednego sezonu może mieć negatywny wpływ na kondycję całej pasieki i jej produkcyjność w kolejnych latach, nawet jeśli zabieg zostanie przeprowadzony ponownie rok później (Bąk i in. 2002). Należy pamiętać, iż nawet dobrze wyleczone rodziny pszczele są narażone na reinwazję pasożytami pochodzącymi z pobliskich pasiek, nie leczonych w tym samym czasie (Shabo 1994). Jednak coroczne stosowanie zabiegów przeciwwarrozowych daje możliwość utrzymania populacji roztocza na poziomie nieszkodliwym dla rodzin pszczelich (Bąk i in. 2013).
Zmagania pszczelarzy z warrozą trwają już dziesiątki lat (Bal i Alen 1988, Brodschneider i in. 2010, Chauzat i in. 2010), a mimo to wciąż nie znaleziono w 100 procentach skutecznej metody pozbycia się pasożyta, który ją wywołuje (Martin i in. 2012; Nazzi i in. 2012). Zakłada się, że lek na warrozę, aby był uznany za skuteczny, powinien niszczyć co najmniej 95% pasożytów w rodzinie pszczelej. Tak wysoką skutecznością charakteryzują się preparaty oparte na tzw. twardej chemii. Substancje czynne tych leków to syntetyczne pyretroidy, pestycydy fosforoorganiczne czy amid kwasu mrówkowego. Niestety pozostałości tych substancji często kumulują się w produktach pszczelich, a szczególnie w wosku (Milani 1995). Sprzyjają temu nieprawidłowe stosowanie leków przeciwwarrozowych oraz podawanie na własną rękę przez pszczelarzy rodzinom pszczelim pestecydów roztoczobójczych nie zarejestrowanych jako leki dla pszczół do walki z warrozą. Prowadzi to do szybkiego powstania populacji roztoczy lekoopornych na ich działanie (Trouiller 1998, Bąk i in. 20012).
W celu wyeliminowania ryzyka kumulowania się pozostałości leków przeciwwarrozowych w produktów pszczelich oraz ryzyka lekooporności V. destructor pszczelarze chętnie sięgają po tzw. „lekką chemię”. Impulsem do tego jest również zaostrzenie przepisów unijnych dotyczących czystości chemicznej produktów żywnościowych. Skutecznymi w leczeniu warrozy substancjami stanowiącymi „lekką chemię” są kwasy organiczne takie jak: szczawiowy, mlekowy i mrówkowy, które naturalnie są obecne w miodzie. Dlatego też Rozporządzenie Komisji (UE) NR 37/2010 z dnia 22 grudnia 2009 r. w sprawie substancji farmakologicznie czynnych i ich klasyfikacji w odniesieniu do maksymalnych limitów pozostałości w środkach spożywczych pochodzenia zwierzęcego zaliczyło kwasy organiczne do grupy substancji, dla których nie trzeba ustanawiać maksymalnych limitów pozostałości.
Kwasy organiczne szczególnie zalecane są do stosowania w zwalczaniu V. detructor w ekologicznych gospodarstwach pasiecznych. Substancje te, przez to, że naturalnie znajdują się w miodzie to ich pozostałości nie stanowią zagrożenia dla zdrowia i życia człowieka (Herman i in. 2003). Mówiąc o produktach pszczelich mamy na myśli czyste chemicznie, ekologiczne wytwory pszczelej pracy. Dlatego też pszczelarze świadomie dbający o jakość swoich produktów chętnie sięgają po kwasy organiczne w walce z roztoczami. Przy czym wiedzę na temat sposobów aplikacji pozyskują oni z literatury pszczelarskiej popularnonaukowej, naukowej oraz stron internetowych o tematyce pszczelarskiej. Ponieważ kwasy organiczne są substancjami toksycznymi i silnie żrącymi, to nie wszystkie formy aplikacji kwasów są bezpieczne dla pszczelarza czy rodziny pszczelej. Chociaż w Polsce dostępne są leki przeciwwarrozowe oparte na kwasach organicznych, to pszczelarze często sięgają po preparaty nie przebadane pod kątem skuteczności i bezpieczeństwa dla pszczół i konsumentów produktów pszczelich. Stosowanie metod niepotwierdzonych, nieskutecznych, może prowadzić do śmierci rodzin pszczelich i znaczących strat nie tylko dla pszczelarza, który doprowadził swoim działaniem do szkody, ale także dla okolicznych rodzin pszczelich pozostających w zasięgu lotu pszczół. Ma to związek z tzw. reinwazją polegającą na przenoszeniu pasożytów z rodzin chorych na zdrowe (m. in. wskutek błądzenia pszczół, rabunków).
Kwas szczawiowy
1. Właściwości fizykochemiczne kwasu szczawiowego i jego obecność w żywności
Kwas szczawiowy o wzorze sumarycznym C2H2O4 jest kwasem dikarboksylowym. Tworzy bezbarwne kryształy o temperaturze topnienia 189°C. Rozpuszcza się w wodzie i w rozpuszczalnikach organicznych tj.: etanol, eter dietylowy itp. Kwas ten znajduje się naturalnie w różnych warzywach (od 300 do 1700 mg/kg) i orzechach (od 2000 do 6000 mg/kg). W miodzie zawartość kwasu szczawiowego według różnych badań wahała się od 8 do 300 mg/kg kwasu szczawiowego (Bogdanov 2002, Bernardini i Garda 2001, Del Nozal i in. 2000). 9 października 2003 roku EMEA (European Agency for the Evaluation of Medical Products) uznała, że związek ten nie jest groźny dla konsumentów miodu pochodzącego od pszczół nim leczonych i umieściła go w aneksie II do Dyrektywy Rady Europy (ECC)2377/99. W miodach wiosennych pochodzących z rodzin pszczelich, w których roztwór kwasu szczawiowego był stosowany zgodnie z zaleceniami, nie stwierdzono podwyższonego poziomu tego związku. Jak do tej pory nie stwierdzono również oporności V. destructor na kwas szczawiowy.
2. Jak stosować kwas szczawiowy?
Kwas szczawiowy w pasiece można stosować jako leczniczy roztwór do polewania pszczół w uliczkach międzyplastrowych. Proponowane są różne stężenia od 3,2% do 4,6% (Hartwig 2006, Büchler 1999, 2000). Przy zastosowaniu wyższego stężenia niż 5% opisano zwiększoną dwukrotnie śmiertelność pszczół jesienią, utrudnioną zimowlę rodzin pszczelich połączoną z ich osłabieniem oraz słaby rozwój wiosenny (Charrière 2001; Liebig 1998, 1999). Stężenia wyższe rzędu 7% prowadzą do poparzenia robotnic, a szczególnie ich układów pokarmowych. A roztwór zawierający 10% i więcej kwasu szczawiowego prowadzi do śmierci pszczół. Należy przy tym pamiętać, że roztwory kwasu szczawiowego są również niebezpieczne dla ludzi i zwierząt. Opary kwasu szczawiowego przedostając się przez drogi oddechowe, skórę oraz przewód pokarmowy mogą prowadzić do ich poparzeń. Powodować mogą również podrażnienie spojówek. W celu skutecznego zwalczania V. destructor stosuje się dawkę 5-8 ml na jedną uliczkę międzyplastrową. Zaleca się jednokrotną aplikację jesienią, tuż po wygryzieniu się ostatniego czerwiu. Zabieg zwalczania pasożytów za pomocą kwasu szczawiowego najlepiej przeprowadzić pod koniec października lub w listopadzie, przy temperaturze powietrza nie niższej niż 0°C (Rosenkranz i in. 2010).
Uważa się, że najbardziej optymalna temperatura stosowania tego kwasu wynosi ok. 10°C. Ponieważ kwas szczawiowy wzmaga zachowania higieniczne robotnic, a tym samym przyspiesza ich metabolizm, to nie może być stosowany powtórnie przed upływem 3 miesięcy. Zabezpiecza to przed zbyt wczesnym zużyciem się pszczół zimowych, które przecież czeka jeszcze wiosną praca polegająca na wychowaniu czerwiu pokolenia pszczoły letniej.
Innym sposobem aplikacji kwasu szczawiowego jest odparowywanie jego kryształków. Do tego celu służy podgrzewacz zwany parownikiem, waporyzatorem lub sublimatorem. Stosuje się dawkę 2-3g kryształków kwasu szczawiowego, które podgrzewa się w zależności od konstrukcji sublimatora od 1 do 3min. Odparowanie kryształków kwasu szczawiowego można przeprowadzać kilka razy w sezonie.
Kwas mrówkowy
1. Właściwości fizykochemiczne kwasu mrówkowego i jego obecność w żywności
Kwas mrówkowy o wzorze sumarycznym jest najprostszym kwasem karboksylowym. Jest obecny w postaci bezbarwnej, żrącej cieczy o ostrym zapachu. Temperatura wrzenia wynosi 100,6°C. Rozpuszcza się w wodzie, alkoholu etylowym, eterze etylowym oraz glicerynie. Kwas ten znajduje się naturalnie m. in. w roślinach (valeriana, juniperus), jak i w jadzie pszczół, czy też mrówek. W miodzie występuje w ilości od 9 do 1229 mg/kg (Stoya i in. 1986, Kary 1987, Talpay 1989, Sabatini i in. 1994, Del Nozal i in. 1998, Bogdanov i in. 2002).
2. Jak stosować kwas mrówkowy ?
Kwas mrówkowy odparowuje się w ulu za pomocą różnych aplikatorów (Ritter i Ruttner 1980, Sharma i in. 1983, Hoppe i in. 1989, Lupo i Gerling 1990, Krämer 1991, Charrière i in. 1997, Vivas 1997). Napełnianie aplikatorów przeprowadza się poza ulem, aby nie dopuścić do wylania się tej żrącej substancji na pszczoły. Thomas (1997) dla uzyskania zadawalającej skuteczności zaproponował ilość odparowania kwasu mrówkowego w ulu na poziomie od 7 do 10 g/d dla uzyskania odpowiedniej kontroli. Imdorf i in. (1995) zalecał dzienne uwalnianie kwasu w ilości 7 g/d w celu osiągnięcia 95% skuteczności. Calderone (2000) stwierdził, że taką skuteczność z zwalczaniu V. destructor uzyskuje się poprzez dzienne uwalnianie kwasu mrówkowego od 13 do 21 g/d w pierwszym tygodniu leczenia i 10 g/d w drugim tygodniu.
Aplikator powinien zawierać podziałkę. Umożliwia to pełną kontrolę nad ilością odparowanego kwasu mrówkowego, aby nie dopuścić do nadmiernego uwalniania się jego oparów do przestrzeni ula. Może to doprowadzić do upadków matek, osypywania się pszczół i zamierania czerwiu (Bolli i in. 1993, Westcott i Winston 1999). Podobne konsekwencje mogą wystąpić przy aplikowaniu kwasu mrówkowego w słabych rodzinach pszczelich, gdzie zbyt mała liczba robotnic nie jest w stanie wentylować prawidłowo gniazda. Kwas mrówkowy jako jedyna substancja Varroa-bójcza dociera pod zasklepy i tam może unicestwiać pasożyty (Calis i in. 1998). Mimo, że kwas ten naturalnie obecny jest w miodzie, to nie należy go stosować w trakcie produkcji miodu towarowego, bo prowadzi to do silnej kumulacji, powyżej 150 mg/kg miodu, co może być wyczuwalne przez konsumentów.
Preparaty z kwasami dostępne na rynku
Pszczelarze mają do dyspozycji również dostępne gotowe leki przeciwwarrozowe oparte na bazie kwasów organicznych. Są to preparaty zawierające kwas szczawiowy, jak i kwas mrówkowy. Jednak wielu pszczelarzy chcąc zmniejszyć nakłady pracy oraz zminimalizować koszty terapii poszukują rozwiązań w postaci tanich i długodziałających preparatów z kwasami organicznymi . Preparatem długookresowym zdobywającym ostatnio dużą popularność wśród pszczelarzy są paski nasączone roztworem kwasu szczawiowego w glicerynie roślinnej (tzw. paski glicerynowo-szczawiowe lub paski szczawiowe). Wstępne doniesienia wskazują, że te preparaty są skuteczne w walce z warrozą (Maggi i in. 2016).
Cel badań
Celem badań było stworzenie receptury oraz rekomendacji wdrożeniowych dla preparatu do zwalczania Varroa destructor o działaniu długookresowym na nośniku stałym, na bazie kwasów organicznych i porównanie go z innym tego typu preparatem stosowanym przez pszczelarzy na terenie Polski
Metody i wyniki
Wstępne receptury preparatu z uwzględnieniem konfiguracji różnych substancji i podłoży (nośników)
Celem działań podjęty przez zespół naukowców Katedry Drobiarstwa i Pszczelnictwa Uniwersytetu Warmińsko Mazurskiego w Olsztynie było stworzenie receptury oraz rekomendacji wdrożeniowych dla preparatu do zwalczania Varroa destructor o działaniu długookresowym na nośniku stałym, na bazie kwasów organicznych. W pierwszej kolejności dokonano badania literaturowego. W tym celu prześledzono publikacje naukowe na temat preparatów przeciwwarrozowych opartych na kwasach organicznych mrówkowym i szczawiowym. Szczególnie uwzględniano: dawki zastosowanych kwasów, składniki baz badanych preparatów, nośniki stałe, na które nanoszono bazy wraz z kwasami. W trakcie badań literaturowych zwracano również uwagę na skuteczność zwalczania Varroa destructor danym preparatem oraz jego bezpieczeństwo dla pszczół i produktów pszczelich oraz ich konsumentów. Wyniki badań literaturowych przedstawiono w tabeli 1.
autor i rocznik |
nazwa handlowa preparatu |
kwas |
nośnik |
receptura |
ilość substancji czynnej w jednej sztuce |
dawkowanie |
skuteczność |
szybkość parowania |
Eguaras i in. 2003 |
brak nazwy |
mrówkowy |
żel karboksypolimetylenowy |
8 g karboksymetylenu and 232 g of formic acid 70% |
240g |
żel nad rodnią i pod rodnią/ 2 tygodnie |
80%-94% |
|
Eguaras i in.1999 |
BeeVar |
mrówkowy |
żel karboksypolimetylenowy |
68% kwasu mrówkowego i 32% karboksipolimetylen |
200 g |
2 tacki co 2 tygodnie |
93-100% |
5 do 9 g/d (Całkowita ilość kwasu mrówkowego podawana do jednego ula podczas całego okresu leczenia wynosiła około 200 g ) |
Feldlaufer i in. 1997 |
Beltsville Formic Acid (BFA) |
mrówkowy |
żel w workach polipropylenowych |
200g żelu |
65% kwas mrówkowy |
Płaskie opakowanie z żelem |
70% |
10-50ppm (najczęściej 10-20 ppm) |
Giusti i in. 2017 |
Varterminator |
mrówkowy |
włóknina |
250 gramów żelu zawierającego 36% kwasu mrówkowego plastikowe pudełka, które łatwo się otwiera. |
90 g |
plastikowe pudełka z preparatem, które łatwo się otwiera umieścic na powałce |
brak danych |
brak danych |
Kochansky i Shimanuki 1999 |
brak nazwy |
mrówkowy |
żel krzemionkowy |
200g żelu |
65% kwas mrówkowy w różnych koncentracjach |
Płaskie opakowanie z żelem |
brak danych |
brak danych |
Maggi i in. 2016 |
szczawiowy |
paski celulozowe (45 cm×3 cm×1,5 mm) |
10 g kwasu szczawiowego z 20 mL gliceryny. |
10g |
4 paski/rodnię/42 dni |
93,10% |
brak danych |
|
Ramos i in. 2010. |
brak nazwy |
mrówkowy |
Żel na bazie skrobi |
200 g żelu i 200 g 85% kwasu mrówkowego |
200g 85% kwasu mrówkowego |
Styropianowy pojemnik z żelem |
73% |
8-12g/d |
Satta i in.. 2005 |
Liebig-Dispenser |
mrówkowy |
dozownika Liebig-Dispenser |
100ml85% kwasu odparowanie |
100 ml |
dozownik |
93-100 |
26 do 35 g/d |
Na podstawie przeprowadzonych badań literaturowych oraz analizy preparatów dostępnych na rynku stworzono sześć receptur (Fot. 1). Głównym założeniem tych receptur było:
1.W skład preparatu przeciwwarrozowego mają wchodzić obydwa kwasy: mrówkowy i szczawiowy
2.Preparat powinien zredukować jak największą liczbę pasożytów natychmiast po zastosowaniu, po czym oddziaływać w sposób ciągły przez okres 2-4 tygodni gwarantując oddziaływanie na roztocza uwalniające się wraz z wygryzającym się czerwiem, a także stanowiąc barierę dla reinwazji pasożyta.
3.Kwas mrówkowy ma być w małej dawce, bezpiecznej dla pszczół w różnych warunkach środowiskowych stosowania, nawet w przypadku szybkiego odparowania całej dawki kwasu na początku stosowania preparatu przy potencjalnie wysokich temperaturach zewnętrznych i ma stanowić dawkę uderzeniową w początkowym okresie stosowania preparatu.
4.Kwas szczawiowy ma parować z preparatu w sposób ciągły przez 2-4 tygodnie, gwarantując oddziaływanie na roztocza uwalniające się wraz z wygryzającym się czerwiem, a także stanowiąc barierę dla reinwazji pasożyta.
5.Baza dla kwasów ma składać się z substancji tanich, neutralnych dla kwasów oraz bezpiecznych dla pszczół, produktów pszczelich oraz ich konsumentów.
6.Nośnik stały, na który będzie naniesiona baza z kwasami ma dobrze znosić kontakt z kwasami. Ma być ponadto ciałem stałym w pojęciu fizycznym i ma zabezpieczać kwasy przed zbyt gwałtownym odparowaniem, co mogłoby zaszkodzić pszczołom.
Powyższe założenia pozwoliły stworzyć wstępne receptury, które przedstawiono w tabeli 3. Czynności wykonane w celu stworzenia 7-miu receptur:
1.Ustalono dawki kwasów mrówkowego na poziomie 10 g/rodzinę pszczelą (tj. 11,5 g 85% kwasu mrówkowego) oraz szczawiowego dwuwodnego na poziomie 40 g/na rodzinę pszczelą.
2. Ustalono składniki baz. Uznano, że najlepszymi substancjami będą tu gliceryna bezwodna jako czynnik spowalniający uwalnianie kwasu, skrobia spożywcza i guma arabska jako czynniki pozwalające uzyskać odpowiednią konsystencję bazy.
3.Wymieszano substancje bazy w różnych proporcjach wraz z wytypowanymi dawkami kwasu w celu uzyskania jak najlepszych właściwości organoleptycznych. Użyto tu mieszadła magnetycznego.
4.Przetestowano wchłanialność nośników stałych i neutralność dla kwasów. Egzamin zdały sorbent polipropylenowy i paski celulozowe. Odrzucono natomiast płytki ceramiczne jako zbyt słabo chłonące.
5.Naniesiono uzyskane bazy z kwasami na nośniki stałe (Fot. 2). W zależności od konsystencji i ilości uzyskanej mieszanki użyto jeden lub dwa jednocześnie nośniki stałe. W przypadku bazy 2 wystarczył jeden pasek dla pełnej dawki leczniczej, a dla pozostałych receptur użyto dwa paski.
 Fot. 1 Uzyskane bazy po wymieszaniu jej składników w różnych proporcjach
Fot. 1 Uzyskane bazy po wymieszaniu jej składników w różnych proporcjach
Naniesiono uzyskane bazy z kwasami na nośniki stałe. W zależności od konsystencji i ilości uzyskanej mieszanki użyto jeden lub dwa jednocześnie nośniki stałe. W przypadku bazy 2 wystarczył jeden pasek dla pełnej dawki leczniczej, a dla pozostałych receptur użyto dwa paski (tab. 2, Fot. 2)
nr receptury |
nośnik |
skład bazy (g) |
kwas mrówkowy 85% (g) |
kwas szczawiowy dwuwodny (g) |
uwagi |
B1 |
- |
Gliceryna (82,5) |
- |
- |
Nie użyto w dalszych badaniach (badano jedynie rozpuszczalność w wodzie i glicerynie) |
B22 |
sorbent polipropylenowy |
gliceryna (23,5) |
11,5g |
40g |
|
B3 |
sorbent polipropylenowy + paski celulozowe |
gliceryna (73,5) guma arabska (15) woda (10) |
11,5g |
40g |
|
B4 |
sorbent polipropylenowy |
gliceryna (48,5) |
11,5g |
40g |
|
B5 |
sorbent polipropylenowy + paski celulozowe |
gliceryna (98,5) |
11,5g |
40g |
|
B6 |
sorbent polipropylenowy + paski celulozowe |
gliceryna (48,5) skrobia (5) woda (45) |
11,5g |
40g |
|
B7 |
sorbent polipropylenowy + paski celulozowe |
gliceryna (48,5) skrobia (5) guma arabska (5) woda (40) |
11,5g |
40g |
nr receptury |
nośnik |
skład bazy (g) |
kwas mrówkowy 85% (g) |
kwas szczawiowy dwuwodny (g) |
uwagi |
1 |
- |
Gliceryna (82,5) |
- |
- |
Nie użyto w dalszych badaniach (badano jedynie rozpuszczalność w wodzie i glicerynie) |
2 |
sorbent polipropylenowy |
gliceryna (23,5) |
11,5g |
40g |
- |
3 |
sorbent polipropylenowy + paski celulozowe |
gliceryna (73,5) |
11,5g |
40g |
- |
4 |
sorbent polipropylenowy |
gliceryna (48,5) |
11,5g |
40g |
- |
5 |
sorbent polipropylenowy + paski celulozowe |
gliceryna (98,5) |
11,5g |
40g |
- |
6 |
sorbent polipropylenowy + paski celulozowe |
gliceryna (48,5) |
11,5g |
40g |
- |
7 |
sorbent polipropylenowy + paski celulozowe |
gliceryna (48,5) |
11,5g |
40g |
- |
 Fot. 2. Uzyskane preparaty na bazie 6-ciu receptur
Fot. 2. Uzyskane preparaty na bazie 6-ciu receptur
Teoretyczna ocena potencjału skuteczności
1. Skuteczność działania kwasu szczawiowego
Charriere i Imdorf (2002) w terenowych badaniach przeprowadzonych na 200 rodzinach pszczelich stwierdzili, że skuteczność 3,5–procentowego roztworu kwasu szczawiowego w zwalczaniu roztoczy wynosi ponad 90%. Większość badań skuteczności zastosowania roztworu kwasu szczawiowego w terapii warrozy w okresie bezczerwiowym wykazała 95% skuteczności (Higes i in. 1999). Thomas (1997) twierdzi, że skuteczność ta dochodzi do 98% i przewyższa roztoczobójcze właściwości kwasu mlekowego. W przypadku pasków celulozowych z kwasem szczawiowym osiągnięto skuteczność 93% (Maggi i in. 2016)
2. Skuteczność działania kwasu szczawiowego
Odparowywanie roztworu kwasu mrówkowego z różnych włóknin i kartoników dawało różną skuteczność: od 27 do 65% kontrola (Hueso 2000), 12-48% (Avila 2001) oraz 34- 65% (Vivas 1997). Wprowadzenie precyzyjnych dozowników zaprojektowanych w celu regulacji i kontroli parowania spowodowało zwiększenie skuteczności. Średnia skuteczność akarycydu w postaci samego płynnego kwasu mrówkowego (Nassenheider Professional®) wyniosła 73,2 ± 12,5% Stosując kwas mrówkowy w żelu uzyskiwano skuteczność Varroa-bójczą na poziomie 70,3% (Feldlaufer i in. 1997) i około 90% (Clark 1991, Eguaras i in. 2001, 2003).
Pietropaoli i Fornato (2020) wykazali iż połączenie wyżej wymienionych zabiegów z kwasem szczawiowym zwiększyło skuteczność odpowiednio do 92,7 ± 7,5% w przypadku Nassenheider Professional oraz do 89,5 ± 9,2% MAQS i 89,4 ± 8,0% Varterminator. Zatem połączenie obydwu kwasów szczawiowego i mrówkowego w jednym preparacie o działaniu długookresowym na nośniku stałym ma duży potencjał zadawalającej skuteczności w zwalczaniu V. destructor.
Badanie laboratoryjne jakości i bezpieczeństwa dla pszczół różnych składów preparatu
Badanie laboratoryjne wykonano w dwóch etapach:
I etap – testowanie wszystkich stworzonych receptur pod kątem jakości i bezpieczeństwa dla pszczół
II etap – porównanie wybranych dwóch receptur preparatu (B4 i B7) z preparatami przeciwwarrozowymi dostępnymi na rynku: pasków glicerynowo-szczawiowych (OA) i z kwasem mrówkowym (FA)
Badanie obejmowało analizę:
- pozostałości kwasów przed i po zastosowaniu z uwzględnieniem utraty masy preparatu
- poziomu parowania kwasu mrówkowego
- śmiertelności robotnic
Badanie przeprowadzono w cieplarkach w temp. 35ºC, wilg. 60%. W tym celu w po środku cieplarki ustawiano po 5 klateczek z pszczołami. W każdej klateczce umieszczono 30 robotnic. Tuż przed samymi klateczkami układano całą dawkę preparatu przeznaczoną na rodzinę pszczelą (Fot. 3). Cieplarki posiadały otwory wentylacyjne o średnicy 5 cm. Eksperyment trwał 48 h. W celu analizy zawartości kwasów w preparacie paski ważono przed włożeniem do cieplarki i po 48 godzinach. Wyniki przedstawiono w tabeli 4 dla etapu I i w tabeli 5 dla etapu II. Analizę parowania kwasu mrówkowego wykonywano po 6, 12, 24 i 48 godz. od włożenia preparatu (fot. 4). Wyniki przedstawiono w tabeli 6 dla etapu I i w tabeli 7 dla etapu II. Analizę śmiertelności robotnic wykonywano po 6, 12, 24 i 48 godz. od włożenia preparatu. Wyniki przedstawiono w tabeli 8. dla etapu I i w tabeli 9 dla etapu II.

Fot. 3. Klateczki z pszczołami umieszczone w cieplarce w celu oceny śmiertelności robotnic
nr receptury |
masa paska przed użyciem(g) |
masa paska po 48h(g) |
różnica w masie(g) |
suma utraconej masy dla I i II (g) |
|||
I |
II |
I |
II |
I |
II |
||
B2 |
77,519 |
- |
67,543 |
- |
9,976 |
- |
9,976 |
B3 |
71,82 |
65,289 |
63,024 |
57,422 |
8,796 |
7,867 |
16,663 |
B4 |
44,911 |
50,256 |
39,705 |
44,838 |
5,206 |
5,418 |
10,624 |
B5 |
75,723 |
76,614 |
75,3 |
76,3 |
0,423 |
0,314 |
0,737 |
B6 |
80,796 |
82,236 |
53,006 |
54,742 |
27,79 |
27,494 |
55,284 |
B7 |
79,132 |
68,452 |
71,361 |
61,926 |
7,771 |
6,526 |
14,297 |
Nr receptury |
Masa paska przed użyciem (g) |
Masa paska po 48h(g) |
Różnica w masie(g) |
Suma utraconej masy dla I i II(g) |
|||||||||
Nr paska |
I |
II |
III |
IV |
I |
II |
III |
IV |
I |
II |
III |
IV |
|
B4 |
71,317 |
61,262 |
- |
- |
60,658 |
52,258 |
- |
- |
10,659 |
- |
- |
10,659 |
|
B7 |
81,049 |
85,013 |
- |
- |
60,479 |
63,479 |
- |
- |
20,570 |
21,534 |
- |
- |
42,104 |
OA |
27,450 |
27,180 |
27,150 |
27,360 |
24,280 |
24,55 |
23,990 |
24,020 |
3,170 |
2,630 |
3,160 |
3,340 |
12,300 |
FA po 2h |
163,166 |
162,255 |
- |
- |
153,920 |
153,13 |
- |
- |
9,246 |
9,125 |
- |
- |
18,371 |
FA po 6h |
160,927 |
164,251 |
- |
- |
141,943 |
145,385 |
- |
- |
18,984 |
18,866 |
- |
- |
37,850 |

Fot. 4. Pomiar stężenia oparów kwasu mrówkowego za pomocą detektora kwasu mrówkowego
nr receptury |
stężenie kwasu mrówkowego po 6 h |
stężenie kwasu mrówkowego po 12 h |
stężenie kwasu mrówkowego po 24 h |
stężenie kwasu mrówkowego po 48h |
B2 |
13 |
25 |
18 |
24 |
B3 |
9 |
17 |
14 |
13 |
B4 |
15 |
13 |
21 |
16 |
B5 |
16 |
21 |
15 |
15 |
B6 |
6 |
3 |
12 |
7 |
B7 |
12 |
18 |
17 |
12 |
nr receptury |
stężenie kwasu mrówkowego po 6 h |
stężenie kwasu mrówkowego po 12 h |
stężenie kwasu mrówkowego po 24 h |
stężenie kwasu mrówkowego po 48h |
B4 |
18 |
17 |
13 |
15 |
B7 |
15 |
16 |
18 |
13 |
FA po 6h |
Poza zakresem przyrządu 80 ppm |
Odstąpiono od pomiarów |
Odstąpiono od pomiarów |
Odstąpiono od pomiarów |
grupa |
po 24h |
po 24h |
po 24h |
po 24h |
suma martwych pszczół |
odsetek martwych pszczół |
B2 |
2 |
1 |
3 |
4 |
10 |
6,67 |
B3 |
0 |
0 |
0 |
0 |
0 |
0,00 |
B4 |
0 |
0 |
0 |
0 |
0 |
0,00 |
B5 |
0 |
0 |
0 |
1 |
1 |
0,67 |
B6 |
0 |
1 |
0 |
4 |
5 |
3,33 |
B7 |
0 |
1 |
1 |
0 |
2 |
1,33 |
K |
0 |
0 |
0 |
2 |
2 |
1,33 |
grupa |
po 24h |
po 24h |
po 24h |
po 24h |
suma martwych pszczół |
odsetek martwych pszczół |
B4 |
0 |
1 |
2 |
0 |
3 |
2,00 |
B7 |
1 |
2 |
1 |
0 |
4 |
2,67 |
OA |
1 |
0 |
4 |
0 |
5 |
3,33 |
FA |
150 |
- |
- |
- |
150 |
100,00 |
K |
0 |
0 |
0 |
0 |
0 |
0,00 |
Badanie terenowe skuteczności i bezpieczeństwa dla pszczół stworzonego preparatu do zwalczania Varroa destructor porównawczo z innymi tego typu preparatami dostępnymi na polskim rynku
Badania terenowe przeprowadzono na 96 młodych rodzinach pszczelich w czerwcu i lipcu, ustawionych na 2 pasieczyskach: Kortowo (48 rodzin) i Kabikiejmy Dolne (48 rodzin) (woj. warm.-maz., powiat olsztyński). Rodziny znajdujące się na pasieczysku Kortowo osadzone były w ulach Ostrowskiej, posiadały wyrównaną siłę (obsiadanie przez pszczoły 5 uliczek międzyplastrowych, w jednym korpusie), a na pasieczysku Kabikiejmy Dolne w ulach Langstrotha. Na pasieczysku w Kabikiejmach Dolnych siła rodzin była zróżnicowana: od 6 do 10 obsiadanych przez pszczoły uliczek międzyplastrowych, w jednym korpusie. Średnia siła w grupach wynosiła od 7,75 do 8. Na tej pasiece tuż przed badaniem dodano drugi korpus z węzą i przełożono do niego po dwa plastry czerwiu z korpusu dolnego. Wszystkie ule posiadały dennice higieniczne. Na obu pasieczyskach wydzielono 4 grupy doświadczalne liczące po 12 rodzin:
grupa B4 – rodziny leczone preparatem na bazie receptury 4
grupa B7- rodziny leczone preparatem na bazie receptury 7
grupa OA - rodziny leczone preparatem na bazie kwasu szczawiowego
grupa K – rodziny pszczele nie leczone na warrozę
Preparaty aplikowano w jak najbliższym sąsiedztwie czerwiu pszczelego, na górnych beleczkach plastrów rodni. W przypadku uli Langstrotha - pomiędzy korpusy, w środek rodni. W przypadku uli ostrowskiej paski z kwasem szczawiowym (OA) zawieszano na plastrach z czerwiem (po 2 paski na ul).


Fot. 5 Aplikowanie preparatów do rodzin doświadczalnych w badaniach terenowych
Badania terenowe obejmowały:
1. badanie śmiertelności robotnic
2. badanie śmiertelności czerwiu pszczelego
3. badania skuteczności zastosowanych preparatów na podstawie poziomu inwazji V. destructor pobranych próbek pszczół przed leczeniem i po leczeniu
4. badania skuteczności zastosowanych preparatów na podstawie osypu pasożyta na wkładki dennicowe Varroa sticky
5. badanie pozostałości kwasów w pasku po zastosowaniu
Badanie śmiertelności pszczół prowadzono przez tydzień od momentu zastosowania preparatu na pasieczysku Kabikiejmy Dolne. Polegały one na ustawieniu przed wylotami uli pojemników, do których wpadały wyrzucane z ula martwe robotnice (fot. 5). Wyniki ze śmiertelności przedstawiono w tabeli 10.

Fot. 5 Badanie śmiertelności pszczół
grupa |
liczba martwych pszczół |
B4 |
125,67 |
B7 |
146,17 |
OA |
87,92 |
K |
94,83 |
W celu badania śmiertelności czerwiu pszczelego w każdej rodzinie pszczelej uczestniczącej w eksperymencie wyznaczono na jednym plastrze fragment czerwiu otwartego w stadium larwy zwiniętej liczący 121 komórek pszczelich. Istotne było, aby plaster z badanym fragmentem znajdował się w gnieździe w bezpośrednim kontakcie z preparatem leczniczym. Każdą z komórek zaznaczono za pomocą wodoodpornego markera punktem na folii przypiętej pinezkami stabilnie do beleczki górnej. Na folii i na beleczce naniesiono identyfikator rodziny pszczelej. Następnie po tygodniu ponownie przyłożono folie w to samo miejsce i za pomocą krzyżyków odznaczono czerw usunięty (Fot. 6). Śmiertelność czerwiu przedstawiono w tabeli 11.

Fot. 6. Ocena terenowa śmiertelności czerwiu pszczelego
grupa |
odsetek zamarłych larw pszczelich |
B4 |
4,12 ab |
B7 |
1,82 b |
OA |
6,21 a |
K |
3,31 ab |
a, b - wartości oznaczone różnymi literami różnią się statystycznie istotnie, brak oznaczenia przy wartości oznacza brak różnic, p-0,05
We wszystkich rodzinach pszczelich na obu pasieczyskach przed leczeniem i po leczeniu pobrano próbki pszczół z centralnej części gniazd w celu oceny stopnia inwazji V. destructor. Działania te wykonano bezpośrednio przed włożeniem preparatów leczniczych do ula i bezpośrednio po ich usunięciu po dwóch tygodniach. Próbki pszczół zostały przebadane w laboratorium metodą flotacji zalecaną w naukowych standardach światowych. Wyniki poziomu inwazji pasożyta w badanych rodzinach przedstawiono w tabeli nr 12.
|
pasieczysko |
grupa |
poziom inwazji V. destructor przed leczeniem |
poziom inwazji V. destructor po leczeniu |
|
Kortowo |
B4 |
0,66 |
0,5 |
B7 |
1,33 |
0,71 |
|
OA |
1,42 |
0,19 |
|
K |
0,93 |
0,72 |
|
|
Kabikiejmy Dolne |
B4 |
1,41 |
1,29 |
B7 |
1,03 |
0,98 |
|
OA |
1,11 |
0,80 |
|
K |
1,15 |
1,65 |
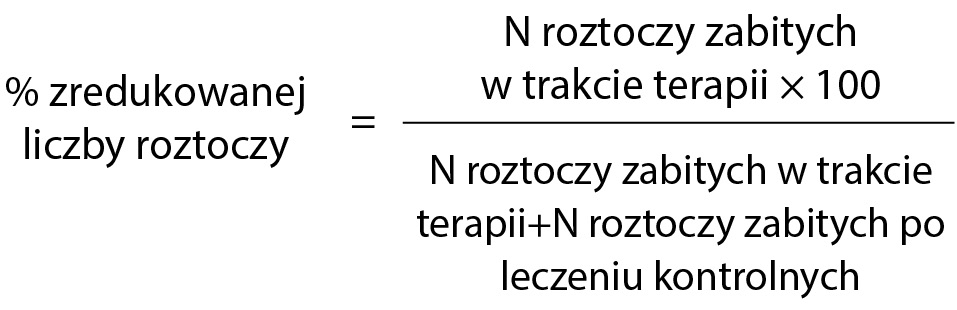
Badania skuteczności zastosowanych preparatów przeprowadzono na podstawie osypu pasożyta na wkładki dennicowe Varroa sticky. Skuteczność preparatu obliczono według formuły podanej przez EMA (2011) w opracowaniu „Wytyczne dla medycznych produktów weterynaryjnych do zwalczania V. destructor oraz w Beebook (2013) „Standard methods for varroa research”. Według tych opracowań skuteczność preparatu wyznacza „% zredukowanej liczby roztoczy” i stosuje się następujący wzór:

Fot. 7. Przykładowa szufladka z dennicy higienicznej z zamontowaną wkładką Varroa-sticky
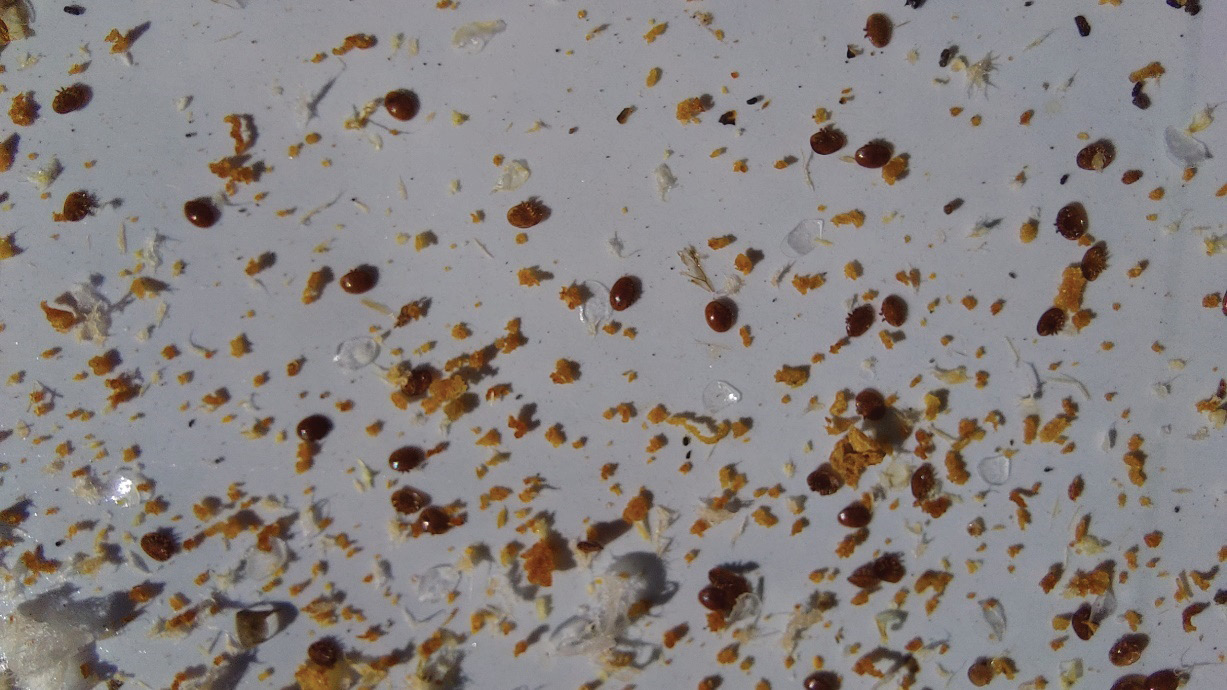
Fot. 8. Osypane pasożyty V. destructor na wkładkę dennicową
Tuż przed zastosowaniem preparatów w dennicach higienicznych założono wkładki Varroa sticky (Fot. 7 i Fot. 8). Po tygodniu zliczono liczbę pasożytów i wymieniono wkładki na świeże. Po kolejnym tygodniu ponownie zarejestrowano liczbę martwych pasożytów osypanych na dennicę i usunięto badane preparaty. Ponownie wymieniono wkładki oraz dokonano leczenia kontrolnego preparatem Apiwarol. Wyliczono skuteczność roztoczobójczą zastosowanych preparatów. Wyniki zestawiono w tabeli 13.
grupa |
liczba V. destructor po leczeniu |
liczba V. destructor po zabiegu kontrolnym |
skuteczność roztoczobójcza preparatów |
|
|
Kortowo |
B4 |
58,25 ab |
24,17 |
60,61 |
B7 |
13,58 b |
25,5 |
43,61 |
|
OA |
83,42 a |
12,75 |
88,64 |
|
K |
21,16 b |
42,67 |
- |
|
|
Kabikiejmy |
B4 |
60,58 |
89,58 |
34,62 |
B7 |
47,83 |
62,45 |
23,45 |
|
OA |
49,08 |
56,17 |
45,50 |
|
K |
17,75 |
88 |
- |
a, b - wartości oznaczone różnymi literami różnią się statystycznie istotnie, brak oznaczenia przy wartości oznacza brak różnic, p-0,05
Przeprowadzono badanie pozostałości kwasów w pasku po zastosowaniu w laboratorium. Próbkę ekstrahowano w wysokoobrotowym mieszalniku b400 firmy BUCHI, w temperaturze <10 st.C w 0,1M wodnym roztworze KOH. Ekstrakt oczyszczano techniką SPE na fazie C18. Oczyszczony ekstrakt poddano analizie chromatograficznej. Wyniki przedstawiono w tabeli 14.
preparat |
masa badanego paska po 7 dniach (g) |
kwas mrówkowy (po 7 dniach) (g) |
kwas szczawiowy po 7 dniach (g) |
B4 |
84,22 |
<0,05 |
13,7 |
B7 |
55,65 |
<0,05 |
20,4 |
Podsumowanie:
Uzyskane wyniki badań laboratoryjnych i terenowych potwierdzają bezpieczeństwo opracowanych receptur dla pszczół i czerwiu. Uśredniona skuteczność varrobójcza preparatów była oceniana po dwóch tygodniach i wyniosła dla preparatu B4 47,61%, dla B7 33,53% i dla OA 67,07%. Uzyskane wyniki należy traktować jako wstępne, gdyż badania prowadzono na rodzinach pszczelich o niskim porażeniu. Jako rekomendację wdrożeniową należy uznać:
- Dążenie do udoskonalenia prototypowej receptury, poprzez dobór nośnika. Preparat B4 posiadał w składzie taką samą ilość kwasu szczawiowego oraz wyłącznie glicerynę jako rozpuszczalnik - jak OA, a ponadto kwas mrówkowy, jako dodatkową substancję czynną, okazał się jednak mniej skuteczny od OA. Różnił się natomiast nośnikiem (sorbent polipropylenowy w B4, paski celulozowe w OA). Nośnik w postaci pasków celulozowych okazał lepszy, pozostaje więc właściwym wyborem.
- Dążenie do udoskonalenia prototypowej receptury, poprzez zwiększenie początkowej dawki kwasu mrówkowego w celu osiągnięcia większej skuteczności varrobójczej, z zachowaniem głównych założeń bezpieczeństwa dla pszczół i długookresowego działania. Badania laboratoryjne wykazały wysoką toksyczność dla pszczół dawki kwasu mrówkowego 70g, uwalnianego z innego nośnika stałego niż stworzone w doświadczeniu preparaty. Badania laboratoryjne i terenowe potwierdziły bezpieczeństwo dla pszczół i czerwiu dawki 10g (11,5g 85% kwasu mrówkowego). Odpowiednią ilość kwasu mrówkowego przeznaczoną do aplikacji na nośnik stały należy rozważać w przedziale od 10g, do wartości mniejszej niż 70g.
- Należy kontynuować badania terenowe w zakresie skuteczności varrobójczej, a także laboratoryjne, w zakresie tempa uwalniania kwasów w dłuższym okresie stosowania preparatu (4 tygodnie).
- Należy kontynuować badania na rodzinach pszczelich o wyższym porażeniu Varroa destructor, we właściwym terminie dla głównego zabiegu zwalczania pasożyta, który prawidłowo powinien rozpocząć się z na przełomie lipca i sierpnia,.
Piśmiennictwo:
Avila R.F. 2001. Uso del ácido fórmico para el control de Varroa jacobsoni O. Dissertation Universidad Autónoma del Estado de México.
Bąk B., Bratkowski J., Wilde J. 2002. Następstwa ograniczonego zwalczania Varroa w rodzinach pszczelich. Biuletyn Naukowy 18(5): 123-130.
Bąk B., Wilde J., Siuda M. 2013. Efficiency of Varroa destructor management with medications used in Poland. Medycyna Weterynaryjna 69(12): 744-748.
Bąk, B., Bratkowski, J., & Wilde, J. 2002. Następstwa ograniczonego zwalczania Varroa w rodzinach pszczelich. Biuletyn Naukowy, 18, 123-130.
Bąk, B., Wilde, J., & Siuda, M. 2013. Efficiency of Varroa destructor management with medications used in Poland. Medycyna Weterynaryjna, 69, 744-748.
Bernardini M., Gardi T. 2001. Influence of acaricide treatments for varroa control on the quality of honey and beeswax, Apitalia 28: 21–24.
Bogdanov S., Charrière J.D., Imdorf A., Kilchenmann V. Fluri P. 2002. Determination of residues in honey after treatments with formic and oxalic acid under field conditions. Apidologie 33(4): 399-409.
Bolli H. K., S. Bogdanov A. Imdorf and Fluri. P. 1993. Initial results of the Ţeld treatment of honey bee colonies infested with Varroa jacobsoni using formic acid in hot climates. American Bee Journal, 129: 735-737
Büchler R. 2000. Oxalsäure – Erfolg mit Nebenwirkungen. Aufträufelmethode beeinträchtigt die Auswinterungsstärke. Allgemeine Deutsche Imkerzeitung , 11: 6–8.
Calderone N.W., Nars M.E. 1999. Evaluation of formic acid formula- tion for the fall control of Varroa jacobsoni (Acari: Varroidae) in colonies of the honey bee Apis mellifera (Hymenoptera: Apidae) in temperate climate. Journal of Economy Entomology , 92: 526-533.
Calis J.N.M., Boot W.J., Beetsma J. i in. 1998. Control of Varroa by com- bining trapping in honey bee worker brood with formic acid treat- ment of the capped brood outside the colony: putting knowledge on brood cell invasion into practice. Journal of Apicultural Research, 37: 205-215.
Charrière J.D., Imdorf A., Fluri P. 1997. A formic acid dispenser against varroatosis of bees. Agrarforschung, 4: 431-434.
Charriére, J.D., Imdorf, A. 2002. Oxalic acid treatment by trickling against Varroa destructor; recommendations for use in central Europe and under temperate climate conditions. Bee World, 83(2): 51-60.
Del Nozal M.J., Bernal J.L., Diego J.C., Gomez L.A., Ruiz J.M., Higes M. 2000. Determination of oxalate, sulfate and nitrate in honey and honeydew by ion-chromatography, Journal of Chromatography A, 881: 629–638.
Eguara M., Palacio M.A., Faverin C., Basualdo M., Del Hoyo M.L., Velis H., Bedascarrasbure E. 2003. Efficacy of formic acid in gel for Varroa control in Apis mellifera L.: importance of the dispenser position inside the hive. Veterinary Parasitology, 111(2-3): 241-245. DOI:10.1016/S0304-4017(02)00377-1.
Eguaras M, Del Hoyo M, Palacio MA, Ruffinengo S, Bedascarrasbure EL. 2001. A new product with formic acid for Varroa jacobsoni Oud. control in Argentina. I. Efficacy. Journal of Veterinary Medicine. B, Infectious Diseases and Veterinary Public Health.. 48(1):11-4. DOI: 10.1046/j.1439-0450.2001.00418.x. PMID: 11254094.
Feldlaufer M. F., Pettis J. S., Kochansky J. P., Shimanuki H. 1997. A gel formulation of formic acid for the control of parasitic mites of honey bees. American Bee Journal, 137: 661-663.
Feldlaufer M., Pettis, J.S.,Kochansky, J.P., Shimanuki, H. 1997. A gel formulation of formic acid for the control of parasitic mites of honey bees. American Bee Journal, 137: 661-663.
Giusti M., Sabelli C., Di Donato A., Lamberti D., Paturzo C.E., Polignano V., Lazzari R. , Felicioli A. 2017. Efficacy and safety of Varterminator, a new formic acid medicine against the varroa mite. Journal of Apicultural Research, 56(2): 162-167. DOI: 10.1080/00218839.2017.1291207
Hartwig A. 2006. Skuteczny, szybki i tani sposób zwalczania warrozy. Pszczelarstwo, 57(9): 8.
Higes, M., Meana, A., Suárez, M., Llorente, J. 1999. Negative long-termeffects on bee colonies treated with oxalic acid against Varroa jacobsoni Oud. Apidologie 30, 289–292
Hoppe H., Ritter W, Stephen E. W. C. 1989. The control of parasitic bee mites: Varroa jacobsoni, Acarapis woodi and Tropilaelaps clareae with formic acid. American Bee Journal, 129:
Hueso G.E.J. 2000. Determinación de la concentración de vapores de ácido fórmico y su efectividad acaricida sobre Varroa jacobsoni Oudemans en colmenas de Apis mellifera L. Dissertation Postgrado Interinstitucional en Ciencias Pecuarias.
Kary I. 1987. Untersuchungen zur Rückstandsproblematik in Bienenhonig im Rahmen der Varroatosebekämpfung, Dissertation, Giessen, Deutschland.
Kochansky J, Shimanuki H. 1999. Development of a gel formulation of formic acid for control of parasitic mites of honey bees. Journal of Agricultural and Food Chemistry, 47(9): 3850-3. DOI: 10.1021/jf9901439. PMID: 10552733.
Krämer K. 1991. Feldversuche mit der Krämer-Platte. Deutche Imker Journal, 9: 384-388.
Liebig G. 1998. Zur Eignung des Aufräufelns von Oxalsäure für die Varroabehandlung. Deutsche Bienenjournal, 6: 4–6.
Liebig G. 1999. Zur Behandlung von Bienenvölkern mit Oxalsäure und “Bienenwohl”. Deutsche Bienenjournal, 10: 4–5.
Liu T. P., Chu L. T. Y., Sporns, P. 1993. Formic acid residues in honey in relation to application rate and timing of formic acid for control of tracheal mites, Acarapis woodi (Rennie). American Bee Journal, 133: 719-721.
Lupo A., Gerling D. A. 1990. Comparison between the efficiency of summer treatments using formic acid and Taktic against Varroa jacobsoni in beehives. Apidologie 21: 261-267.
Maggi M., Tourn E., Negri P., Szawarski N., Marconi A., Gallez L., Medici S. Ruffinengo S., Brasesco C., De Feudis L., Quintana S., Sammataro D., Eguaras M. 2016. A new formulation of oxalic acid for Varroa destructor control applied in Apis mellifera colonies in the presence of brood. Apidologie, 47: 596–605, DOI: 10.1007/s13592-015-0405-7.
Pechhacker H., Heidrun U., Franz B., Andreas H L. 2003. Investigations on the oxalic acid content of honey from oxalic acid treated and untreated bee colonies. European Food Research and Technology, 217: 49-52. DOI: 10.1007/s00217-003-0698-z.
Pietropaoli M., Formato G. 2022. Formic acid combined with oxalic acid to boost the acaricide efficacy against Varroa destructor in Apis mellifera, Journal of Apicultural Research, 61:3, 320-328, DOI: 10.1080/00218839.2021.1972634
Ramos A., Otero-Colina F., Sánchez-Arroyo G., Santillán-Galicia M.T., Tecante A. 2010. A gel formulation of formic acid for control of Varroa destructor . Trends in Acarology: 545–549. DOI:10.1007/978-90-481-9837-5_94.
Ritter W., Ruttner F. 1980. Neue Wege in der Behandlung der Varroatose (New methods in the treatment of varroatosis). Allgemeine Deutsche Imkerzeitung , 14: 151-155.
Ritter W., Ruttner, F., 1980. Neue Wege in der Behandlung der Varroatose (New methods in the treatment of varroatosis). Allgemeine Deutsche Imkerzeitung , 14: 151-155
Rosenkranz P., Aumeier P., Ziegelmann B. 2010. Biology and control of Varroa destructor. Journal of Invertebrate Pathology, 2010, 103: 96-119. DOI: 10.1016/j.jip.2009.07.016.
Sabatini A.G., Marcazzan G.L., Colombo R., Garagnani M. 1994. Applicazione di un metodo enzimatico per la determinazione dell’acido formico e dell’acido lattico presenti nel miele. Apicoltura 9, 135–145.
Satta A., Floris I., Eguaras M., Cabras P., Garau V., Melis M. 2005. Formic acid-based treatments for control of Varroa destructor in a Mediterranean area. Journal of Economic Entomology, 98: 267-73. DOI:10.1603/0022-0493-98.2.267.
Sharma O. P., Garg R., Dogra G. S. 1993. Efficacy of formic acid against Acarapis woodi (Rennie). Indian Bee Journal 45: 1-2.
Stoya W., Wachendörfer G., Kary I., Siebentritt P., Kaiser E. 1986. Ameisensäure als Therapeutikum gegen Varroatose und ihre Auswirkungen auf den Honig, Deutsche Lebensmittel-Rundsch. 82, 217–221.
Talpay B. 1989. Inhaltsstoffe des Honigs-Ameisensäure (Formiat), Deutsche Lebensmittel-Rundsch. 85: 143–147.
Thomas, H.U. 1997. Practical aspects of alternative varroa control methods, pp. 22-30. In P. Munn and R. Jones [eds.], Varroa! Fight the Mite. IBRA, Cardiff, UK.
Vivas R.J.A. 1997. Combate de Varroa jacobsoni Oud. (Gamasida: Varroidae) mediante prácticas culturales y tratamientos con ácido fórmico en colonias de Apis mellifera L. (Hymenoptera: Apidae). Tesis de maestría en ciencias Colegio de Postgraduados.
Vivas R.J.A. 1997. Combate de Varroa jacobsoni Oud. (Gamasida: Varroidae) mediante prácticas culturales y tratamientos con ácido fórmico en colonias de Apis mellifera L. (Hymenoptera: Apidae). Tesis de maestría en ciencias Colegio de Postgraduados.
Westcott L. C., Winston M.L. 1999. Chemical acaricides in Apis mellifera (Hymenoptera: Apidae) colonies: do they cause nonlethal effects? The Canadian EntomologistCan. Entomol. 131: 363- 371.


